腫瘤嗜酸,它自己會通過有(yǒu)氧糖酵解産(chǎn)生乳酸。
近年來,大量的基礎研究告訴我們,腫瘤産(chǎn)生的乳酸,隻能(néng)用(yòng)四個字去形容。
惡貫滿盈!
就在兩個多(duō)月前,蘇州大學(xué)周芳芳團隊發現,乳酸會以乳酸化的形式導緻抑癌蛋白p53失活,進而促進癌症的進展[1]。
除此之外,我們之前還報道過:乳酸可(kě)以将瘤内的巨噬細胞從抗癌型變成促癌型[2-4],可(kě)以增強調節性T細胞的免疫抑制功能(néng)[5],甚至還能(néng)導緻PD-1抑制劑變成促進免疫抑制的“毒藥”[6]。
還真是無惡不作(zuò)!
然而,今天中(zhōng)山(shān)大學(xué)附屬第七醫(yī)院張常華/何裕隆,中(zhōng)山(shān)大學(xué)孫逸仙紀念醫(yī)院尹東,以及英國(guó)癌症研究院Axel Behrens組成的聯合團隊,在頂級期刊《自然》上發表一項重磅研究成果,又(yòu)刷新(xīn)了我對乳酸的認知[7]。
原來,腫瘤還可(kě)以利用(yòng)乳酸幫自己抵擋放化療的傷害。具(jù)體(tǐ)來說,乳酸可(kě)以促進癌細胞修複斷裂的DNA,維持癌細胞基因組的穩定,讓想通過擾亂癌細胞基因組殺死癌細胞的放化療失效。
乳酸又(yòu)罪加一等!
中(zhōng)山(shān)大學(xué)附屬第七醫(yī)院的陳恒星、中(zhōng)山(shān)大學(xué)孫逸仙紀念醫(yī)院的李贇和英國(guó)癌症研究院的李華福是論文(wén)的共同第一作(zuò)者。

▲ 論文(wén)首頁(yè)截圖
在研究的一開始,研究人員就想了解胃癌是如何應對新(xīn)輔助化療帶來的DNA損傷的。
他(tā)們首先對接受過鉑類新(xīn)輔助化療(NAC)的胃癌術後标本,進行了蛋白質(zhì)組學(xué)和非靶向代謝(xiè)組學(xué)分(fēn)析。
在對比對鉑類新(xīn)輔助化療敏感或耐受樣本的蛋白和代謝(xiè)組數據之後,他(tā)們發現合成乳酸的乳酸脫氫酶(LDHA)是耐藥腫瘤中(zhōng)上調最高的蛋白質(zhì)之一,而且乳酸是耐藥腫瘤中(zhōng)含量最高的代謝(xiè)物(wù)之一。
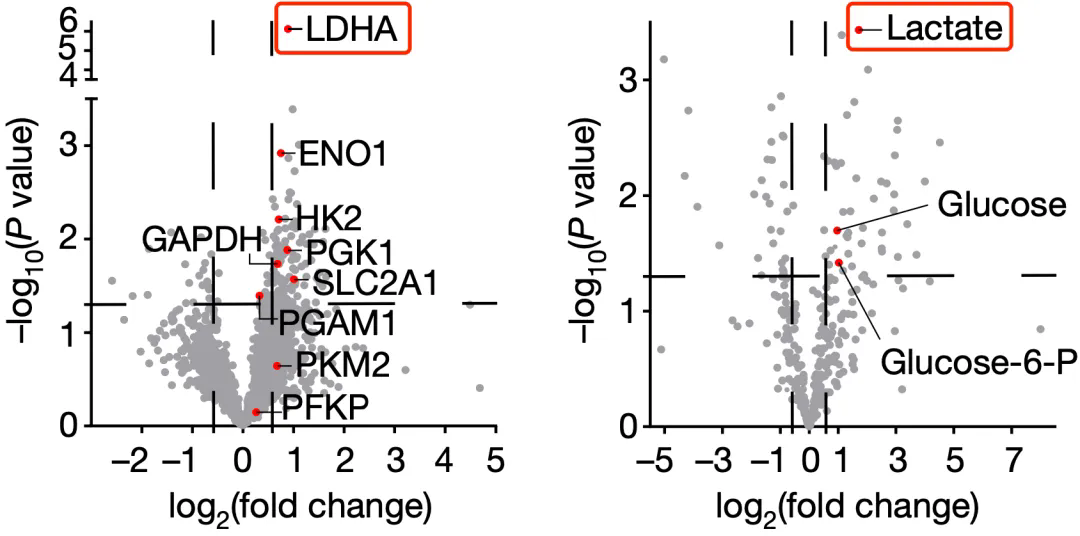
▲ 乳酸暴露了
很(hěn)顯然,耐藥的矛頭直指乳酸。
于是,研究人員将對化療敏感的人胃癌細胞系(MGC803-P)移植到小(xiǎo)鼠身上,他(tā)們發現單用(yòng)乳酸鹽不會影響腫瘤的生長(cháng),但是乳酸鹽會削弱順鉑抑制腫瘤生長(cháng)的效果,并縮短小(xiǎo)鼠的存活時間。不過,一旦消耗掉腫瘤細胞中(zhōng)的乳酸攝取轉運體(tǐ)MCT1,乳酸就不會促進順鉑耐藥性的産(chǎn)生。
他(tā)們又(yòu)嘗試了另一種DNA損傷抗癌療法——放療(IR),發現乳酸鹽也能(néng)增強腫瘤對放療的抵抗力。
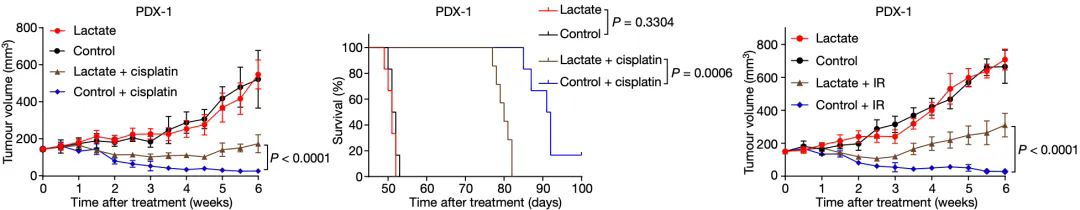
▲ 乳酸對放化療的影響
以上的實驗現象說明,乳酸、DNA損傷修複和放化療之間存在密切關系。
那乳酸又(yòu)是如何影響放化療帶來的DNA損傷呢(ne)?
研究結果表明,乳酸顯著提高了癌細胞的同源重組(HR)修複效率,但僅輕微提高了癌細胞的非同源末端連接(NHEJ)修複效率。顯然,乳酸參與了癌細胞中(zhōng)HR介導的DNA修複,并主要通過這個途徑幫助癌細胞保持基因組的穩定性,避免癌細胞的死亡。
在揭示背後的具(jù)體(tǐ)分(fēn)子機制的時候,研究人員想到了乳酸化。
早在2019年,芝加哥(gē)大學(xué)趙英明團隊就首次揭示:乳酸可(kě)以作(zuò)為(wèi)組蛋白翻譯後的表觀遺傳學(xué)修飾(也就是乳酸化),通過調控基因表達,改變巨噬細胞的表型[3]。我在前面也提到過,蘇州大學(xué)周芳芳團隊也發現乳酸會以乳酸化的形式導緻抑癌蛋白p53失活。
不難看出,乳酸化是腫瘤利用(yòng)乳酸的一種重要手段。
于是研究人員全面分(fēn)析了DNA修複與乳酸化的關系,篩選出了賴氨酸乳酸化水平升高的DNA修複相關蛋白,其中(zhōng)的NBS1引起了他(tā)們的注意,因為(wèi)NBS1是MRN複合物(wù)(MRE11-RAD50-NBS1)的關鍵組成部分(fēn),而MRN複合物(wù)在感知DNA雙鏈斷裂和激活DNA修複途徑方面發揮着關鍵作(zuò)用(yòng)。
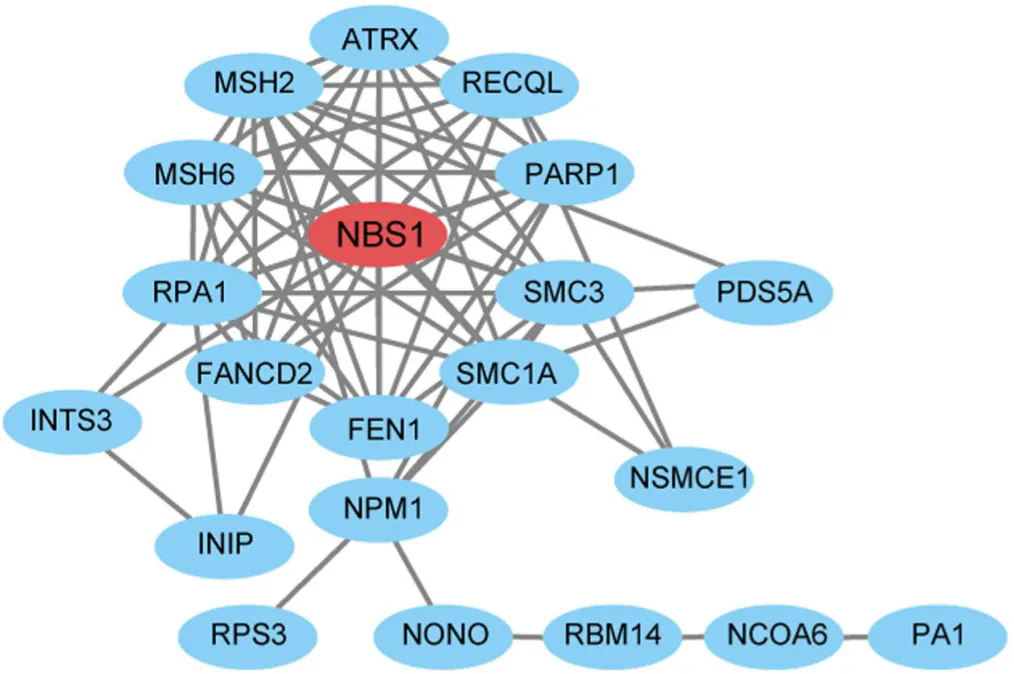
▲ NBS1居C位
基于人胃腺癌細胞系的研究表明,隻要耗盡NBS1,乳酸就失去了促進癌細胞對順鉑耐受的能(néng)力。因此,研究人員重點研究了NBS1的乳酸化。
研究結果顯示,NBS1的第388位賴氨酸(K388)是關鍵所在。當NBS1的K388被乳酸化之後,會促進MRE11-RAD50和NBS1的相互作(zuò)用(yòng),而K388恰好就位于相互作(zuò)用(yòng)界面上。
後續研究還發現,NBS1乳酸化不僅促進了MRN複合物(wù)的形成,還促進了HR蛋白向DNA斷裂位點的聚集。
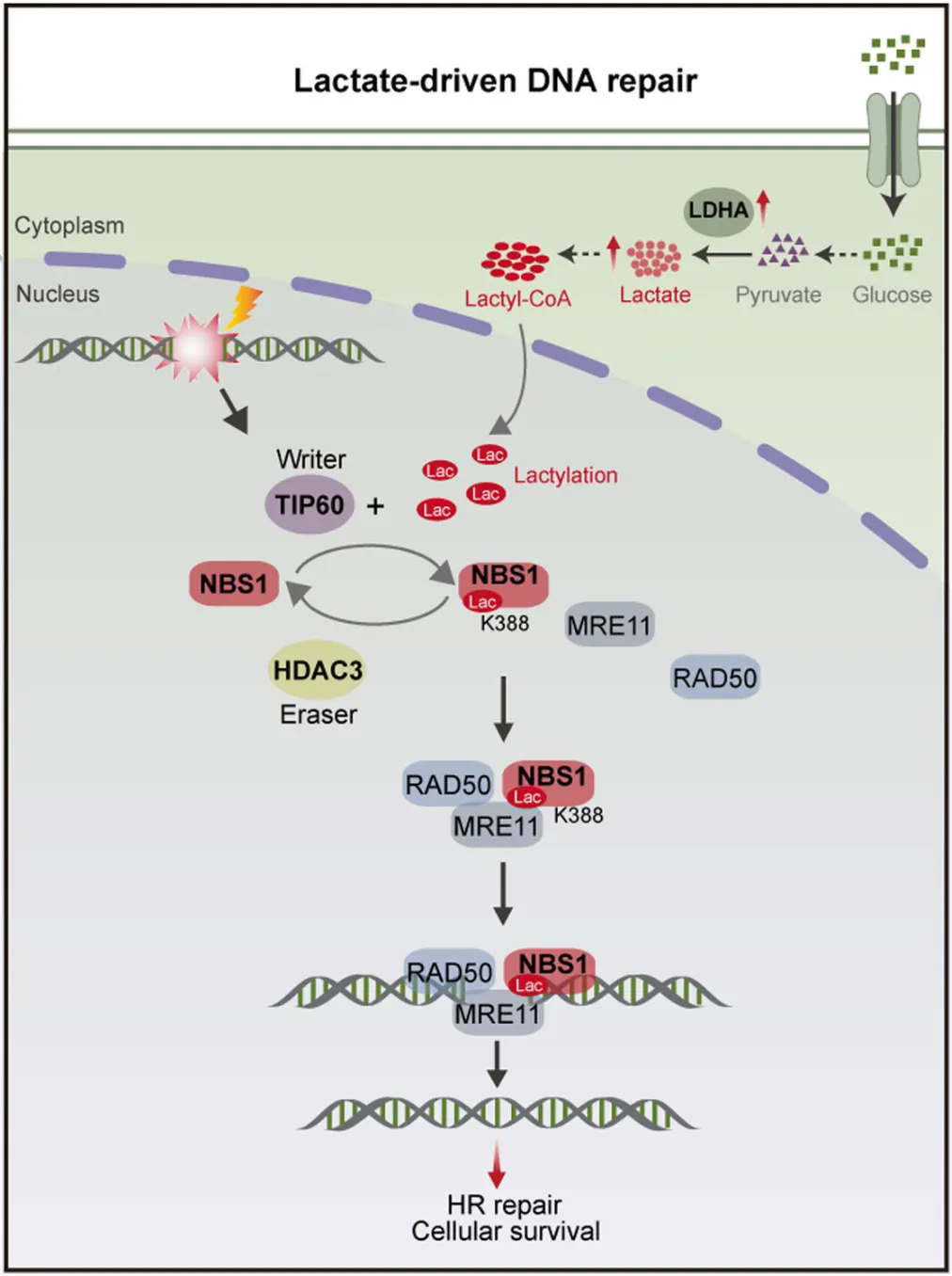
▲ 乳酸促進癌細胞DNA修複的機制示意圖
既然搞清楚了乳酸作(zuò)惡的方式,研究人員就測試了兩種乳酸脫氫酶(LDHA)抑制劑的效果,發現已經獲批上市的抗癫痫藥物(wù)司替戊醇(stiripentol)能(néng)顯著減少乳酸的産(chǎn)生和NBS1 K388的乳酸化。
在胃癌患者來源的腫瘤類器官(PDO)和人源性組織異種移植(PDX)小(xiǎo)鼠模型中(zhōng),司替戊醇與化療或放療聯合使用(yòng),均有(yǒu)強烈的協同抗癌效果,并延長(cháng)小(xiǎo)鼠的生存時間。
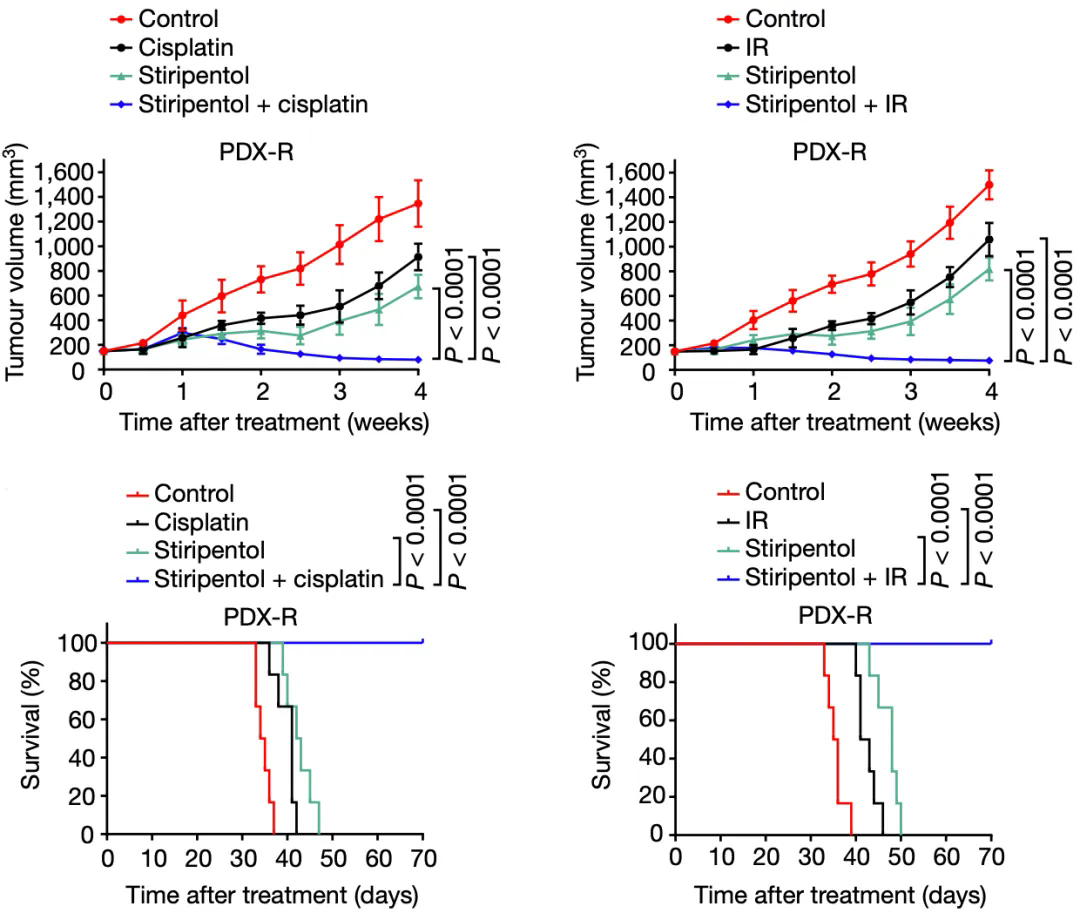
▲ 司替戊醇能(néng)增強放化療的效果
在研究的最後,研究人員探索了乳酸化與癌症患者預後的關系,他(tā)們發現,乳酸脫氫酶的表達和NBS1 K388乳酸化,均與新(xīn)輔助化療的臨床耐藥性相關。NBS1 K388乳酸化水平高或乳酸脫氫酶水平高的患者,總生存率遠(yuǎn)低于水平低的患者。
總的來說,張常華/何裕隆/尹東/Axel Behrens領銜的這項研究再次證實乳酸化對腫瘤的生存有(yǒu)重要作(zuò)用(yòng),他(tā)們也首次發現乳酸化可(kě)以促進癌細胞DNA損傷的修複,以及抗癫痫藥物(wù)司替戊醇有(yǒu)提升放化療效果的潛力。
據了解,中(zhōng)山(shān)大學(xué)附屬第七醫(yī)院已經注冊了名(míng)為(wèi)“司替戊醇聯合免疫靶向化療用(yòng)于常規治療無效的腹膜轉移癌患者單臂前瞻性單中(zhōng)心試驗”的單臂、II期前瞻性臨床研究(注冊号:ChicTR2400083649)[8],探讨司替戊醇聯合靶向免疫化療用(yòng)于化療聯合免疫和靶向治療進展的腹膜轉移癌患者的安(ān)全性和有(yǒu)效性,從而為(wèi)逆轉腫瘤耐藥和晚期腫瘤患者綜合治療提供新(xīn)的策略。
期待這項臨床研究早日取得成功。
參考文(wén)獻:
[1].Zong et al., Alanyl-tRNA synthetase, AARS1, is a lactate sensor and lactyltransferase that lactylates p53 and contributes to tumorigenesis. Cell. 2024. doi:10.1016/j.cell.2024.04.002
[2].Bohn T, Rapp S, Luther N, et al. Tumor immunoevasion via acidosis-dependent induction of regulatory tumor-associated macrophages. Nat Immunol. 2018;19(12):1319-1329. doi:10.1038/s41590-018-0226-8
[3].Zhang D, Tang Z, Huang H, et al. Metabolic regulation of gene expression by histone lactylation. Nature. 2019;574(7779):575-580. doi:10.1038/s41586-019-1678-1
[4].Qian Y, Galan-Cobo A, Guijarro I, et al. MCT4-dependent lactate secretion suppresses antitumor immunity in LKB1-deficient lung adenocarcinoma. Cancer Cell. 2023;41(7):1363-1380.e7. doi:10.1016/j.ccell.2023.05.015
[5].Watson MJ, Vignali PDA, Mullett SJ, et al. Metabolic support of tumour-infiltrating regulatory T cells by lactic acid. Nature. 2021;591(7851):645-651. doi:10.1038/s41586-020-03045-2
[6].Kumagai S, Koyama S, Itahashi K, et al. Lactic acid promotes PD-1 expression in regulatory T cells in highly glycolytic tumor microenvironments. Cancer Cell. 2022;40(2):201-218.e9. doi:10.1016/j.ccell.2022.01.001
[7].Chen, H., Li, Y., Li, H. et al. NBS1 lactylation is required for efficient DNA repair and chemotherapy resistance. Nature. 2024. doi:10.1038/s41586-024-07620-9
[8].https://www.chictr.org.cn/showproj.html?proj=221035
----------THE END----------免責聲明:本文(wén)系轉載分(fēn)享,文(wén)章觀點、内容、圖片及版權歸原作(zuò)者所有(yǒu),如涉及侵權請聯系删除!