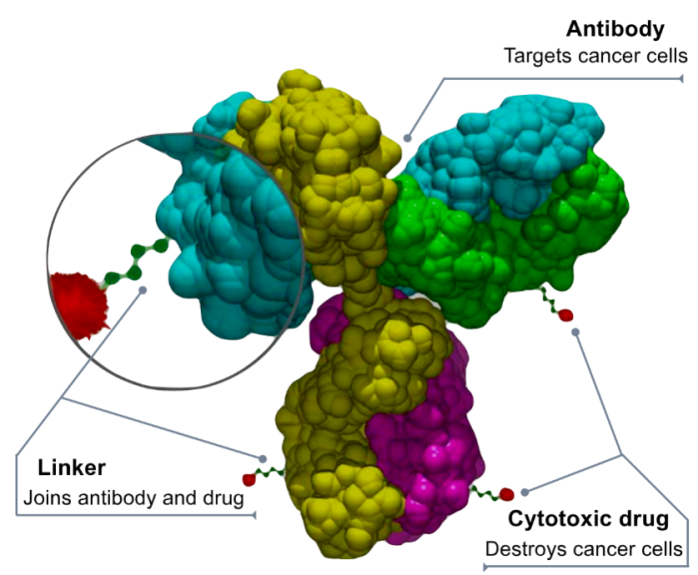
ADC藥物(wù)主要應用(yòng)于抗腫瘤領域,是近年來熱門的研究方向之一。
ADC由單克隆抗體(tǐ)(mAb)、偶聯鏈(linker)和細胞毒性小(xiǎo)分(fēn)子(cytotoxin/payload)三部分(fēn)組成,通過單克隆抗體(tǐ)與腫瘤細胞表面的特異性抗原結合,将細胞毒藥物(wù)定向遞送到腫瘤病竈。
對比傳統的化藥和生物(wù)藥,明顯提升了安(ān)全性和有(yǒu)效性。ADC領域在近10年來取得了長(cháng)足的發展,治療窗口不斷擴大,根據Evaluate Pharma和BCG的預測,全球ADC市場預計2024年将達到129億美元,2018至2024年的年複合增長(cháng)率約為(wèi)35%。
01
國(guó)外ADC藥物(wù)及市場分(fēn)析
近一年,國(guó)外抗體(tǐ)偶聯藥物(wù)(ADCs)賽道熱點不斷,去年9月,吉利德(dé)以108%的溢價、總值210億美元收購(gòu)了ADC公(gōng)司Immunomedics,引發了不亞于當年119億美元收購(gòu)KITE的業内高度關注,近期,輝瑞把兩款ADC候選産(chǎn)品轉手給了Pyxis。
目前,全球共有(yǒu)11個ADC藥物(wù)獲批,包括Mylotarg(輝瑞)、Adcetris(Seattle Genetics/武田)、Kadcyla(羅氏)、Besponsa(輝瑞)、Lumoxiti(阿斯利康)、Polivy(羅氏)、Padcev(Seattle Genetics/安(ān)斯泰來/默沙東)、Enhertu(阿斯利康/第一三共)、Trodelvy(Immunomedics)、Blenrep(GSK)、Akalux(Rakuten Aspyrian)。
從已上市藥品的研發企業看,基本是輝瑞、Seattle Genetics、羅氏及阿斯利康四家各有(yǒu)2款,其他(tā)3家公(gōng)司各1款。
輝瑞的Mylotarg是最早獲批的ADC藥物(wù),2000年5月FDA批準其用(yòng)于治療首次複發的CD33陽性急性髓系白血病(AML)的60歲以上患者,不過基于後期Mylotarg未顯示出明顯的臨床益處并存在一定的安(ān)全問題,2010年輝瑞将Mylotarg退市直到2017年9月才在再次在美國(guó)上市,2020年6月該藥擴大适應症至年齡≥1個月、新(xīn)診斷的CD33陽性AML患者。
Kadcyla和Adcetris則逐漸成長(cháng)為(wèi)“重磅炸彈”藥物(wù),在2019年雙雙突破10億美元關卡,分(fēn)别達到10.81億美元和15.72億美元。Kadcyla已成為(wèi)HER2陽性乳腺癌在國(guó)際上的二線(xiàn)标準治療方案,2019年5月Kadcyla還被FDA批準為(wèi)HER2陽性早期乳腺癌患者的輔助治療方案,市場空間進一步擴容。目前這2款藥已分(fēn)别于2020年1月和5月在中(zhōng)國(guó)獲批上市,其中(zhōng)Kadcyla(赫塞萊)已納入2020年醫(yī)保目錄。
作(zuò)為(wèi)第三代ADC,Enhertu和Trodelvy勢頭強勁。2019年12月獲批的Enhertu适應症為(wèi)HER2陽性乳腺癌,鑒于其龐大的患者群體(tǐ),該藥市場前景巨大,同時,今年1月,Enhertu進一步擴大适應症,FDA批準其用(yòng)于治療HER2陽性的局部晚期或轉移性胃癌和胃食管結合部腺癌患者。根據阿斯利康的年報,Enhertu将成為(wèi)乳腺癌新(xīn)晉标準方案,首年銷售額2億美元。
2020年5月獲批的Trodelvy則是全球首個TROP-2靶向抗體(tǐ)-藥物(wù)偶聯療法,也是Immunomedics成立37 年以來上市的首款藥物(wù),而該藥在上市的頭兩個月就達到了2010萬美元得淨銷售額。SGEN曾試圖以20億美元收購(gòu)Immunomedics但未果,最終讓吉利德(dé)入手。2020年9月吉利德(dé)以108%的溢價、總值210億美元收購(gòu)了Immunomedics,也将Trodelvy一并收入囊中(zhōng)。行業分(fēn)析人士此前表示Trodelvy上市後的銷售峰值預計将達到10億美元以上,吉利德(dé)的買買買戰略為(wèi)其在ADC盤子裏謀得了一塊大蛋糕。
此外,其他(tā)近幾年上市的幾款ADC藥物(wù)均未實現放量,不過據科(kē)睿唯安(ān)預測,到2024年将有(yǒu)多(duō)款年銷售額突破10億美元,包括Polivy和Enhertu等。
除了已上市的11款ADC,據ClinicalTrials.gov的數據顯示,截止今年3月19日全球共有(yǒu)155項ADC藥物(wù)臨床試驗正在進行,且還在不斷增長(cháng),同時,各大巨頭們也通過買買買不斷得擴充自己得ADC管線(xiàn)。2020年11月默沙東以27.5億美元收購(gòu)了VelosBio,12月勃林格殷格翰以11.8億歐元收購(gòu)了NBE Therapeutics,此外Sterling宣布計劃在2021第一季度全面收購(gòu)英國(guó)的ADC Biotechnology。
02
國(guó)内主要的ADC藥物(wù)及研發企業
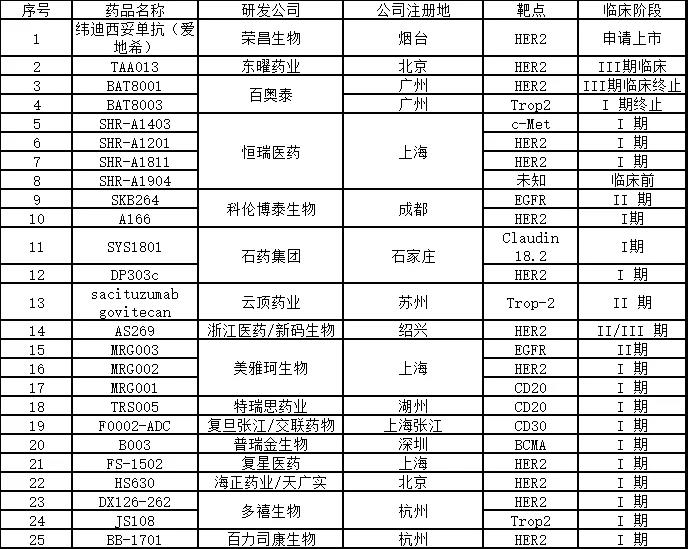
在中(zhōng)國(guó),得益于國(guó)内的創新(xīn)藥研發水平不斷提升,國(guó)内企業在 ADC 藥物(wù)研發上也迅速跟進。其中(zhōng)榮昌生物(wù)的 HER2 ADC 藥物(wù) RC48 已經獲得國(guó)家藥監局上市申請正式受理(lǐ),是國(guó)内進展最快的自主研發 ADC 藥物(wù);此外有(yǒu)二十多(duō)種處于不同階段臨床試驗中(zhōng)的ADC藥物(wù)正在開發中(zhōng),包括東曜藥業、恒瑞醫(yī)藥、科(kē)倫藥業、雲頂新(xīn)耀、百奧泰、浙江醫(yī)藥等多(duō)個公(gōng)司有(yǒu)産(chǎn)品已經進入臨床階段。除了大多(duō)數針對HER2靶點外,其他(tā)靶點包括c-Met、EGFR、Trop-2、CD20、BCMA等。
榮昌生物(wù) 緯迪西妥單抗
緯迪西妥單抗(商(shāng)品名(míng):愛地希®,研究代号:RC48)由榮昌生物(wù)研發,是國(guó)内首個提交新(xīn)藥上市申請的自主開發的抗體(tǐ)-藥物(wù)偶聯(ADC)藥物(wù)。它以腫瘤表面的HER2蛋白為(wèi)靶點,能(néng)精(jīng)準識别癌細胞并與之結合,穿透細胞膜進入其内部,從而殺死癌細胞。該藥于2015年成為(wèi)首個獲批進入臨床研究的ADC藥物(wù)。2020年8月27日,國(guó)家藥監局已正式受理(lǐ)該藥用(yòng)于治療局部晚期或轉移性胃癌(包括胃食管結合部腺癌)患者的新(xīn)藥上市申請,并納入優先審評審批程序,受理(lǐ)号:CXSS2000044國(guó)。此外,維迪西妥單抗(RC48)還于2020年9月獲美國(guó)FDA突破性療法認定用(yòng)于治療尿路上皮癌。
東曜藥業TAA013
TAA013是由東曜藥業研發的一種含有(yǒu)曲妥珠單抗和美坦新(xīn)衍生物(wù)(曲妥珠-MCC-DM1)的在研ADC藥物(wù)。該藥借助曲妥珠單抗的靶向性,與腫瘤細胞膜上的特異性抗原結合,誘發胞吞作(zuò)用(yòng),使高活性細胞毒性藥物(wù)DM1進入細胞,進而誘發細胞凋亡,用(yòng)于治療HER2陽性乳腺癌患者。
目前TAA013 III期臨床研究正在進行中(zhōng),這是一項多(duō)中(zhōng)心、随機、平行對照、開放标簽研究,針對經曲妥珠單抗治療失敗的、不可(kě)切除的局部晚期或轉移性HER2陽性乳腺癌患者,對比拉帕替尼聯合卡培他(tā)濱的有(yǒu)效性和安(ān)全性,從而進一步驗證TAA013的有(yǒu)效性和安(ān)全性。
恒瑞醫(yī)藥 SHR-A1811
恒瑞醫(yī)藥作(zuò)為(wèi)國(guó)内創新(xīn)藥研發龍頭企業,在 ADC 領域也有(yǒu)很(hěn)深的布局。目前公(gōng)司靶向 c-MET 的 ADC 藥物(wù) SHR-A1403,以及靶向 HER2 的 SHR-A1201 和 SHR-A1811 都處于臨床階段。今年1月,恒瑞醫(yī)藥第四款ADC藥物(wù)SHR-A1904的臨床實驗申請也獲得國(guó)家藥監局受理(lǐ)。
注射用(yòng)SHR-A1811是恒瑞醫(yī)藥自主研發的以HER2為(wèi)靶點的抗體(tǐ)藥物(wù)偶聯物(wù)(ADC),它可(kě)與HER2表達細胞的細胞膜表面相結合,然後内吞入細胞到達溶酶體(tǐ)釋放小(xiǎo)分(fēn)子毒素,最終誘導腫瘤細胞凋亡,兼具(jù)了抗體(tǐ)的高度靶向性以及細胞毒藥物(wù)對靶細胞的強大殺傷力。
科(kē)倫藥業 SKB264
2020年4月8日,CDE 官網顯示,四川科(kē)倫博泰生物(wù)醫(yī)藥股份有(yǒu)限公(gōng)司的 1 類新(xīn)藥注射用(yòng) SKB264獲臨床默示許可(kě),拟用(yòng)于實體(tǐ)瘤的治療。注射用(yòng) SKB264是靶向人滋養層細胞表面抗原 2(TROP-2)的 ADC 藥物(wù),在多(duō)種上皮來源腫瘤中(zhōng)高表達,其偶聯方式和毒素小(xiǎo)分(fēn)子具(jù)有(yǒu)自主知識産(chǎn)權,拟用(yòng)于惡性腫瘤治療。注射用(yòng) SKB264通過新(xīn)型偶聯方式實現高毒素負載,工(gōng)藝穩定可(kě)控、易于放大,産(chǎn)品批間一緻性好。今年8月23日,科(kē)倫藥業控股子公(gōng)司KLUS PHARMA INC收到FDA簽發的書面通知,允許其“注射用(yòng)SKB264”抗體(tǐ)偶聯藥物(wù)(ADC)在美開展臨床試驗。截至目前科(kē)倫藥業在該藥上已投入約2500萬元研發費用(yòng)。
此外,科(kē)倫藥業ADC藥物(wù)還有(yǒu)靶向HER2的A166,已向 CDE 提交關鍵Ⅱ期申請;靶向Claudin 18.2的ADC藥物(wù)将在2021年進入臨床。
石藥集團 SYS1801
石藥集團自主研發的Claudin 18.2靶向ADC藥物(wù)SYS1801是國(guó)内藥企首個Claudin 18.2靶向的ADC藥物(wù),2020年11月26日,該藥用(yòng)于治療胃癌(包括胃食管交界處癌)的适應症獲得FDA 孤兒藥資格認定。
此外,2019年7月25日,石藥集團重組人源化抗HER2單抗-MMAE偶聯藥物(wù)注射液(DP303c)獲批臨床,适應症為(wèi):晚期Her2陽性乳腺癌。
美雅珂生物(wù) MRG003
該公(gōng)司目前有(yǒu)三個自主研發的創新(xīn)ADC藥物(wù)MRG003、MRG002、MRG001已獲得NMPA的臨床批件,三個I期臨床研究正在進行中(zhōng)。
多(duō)禧生物(wù) DX126-262
該公(gōng)司研發的新(xīn)一代ADC藥物(wù)DX126-262(DAC-001)已獲得國(guó)家藥監局的臨床試驗批件,治療Her2乳腺癌、胃癌。美國(guó)臨床申報正在進行中(zhōng)。
浙江特瑞思 TRS005
特瑞思自主研發的ADC藥物(wù)TRS005用(yòng)于複發難治型非霍奇金氏淋巴瘤,2018年5月,注射用(yòng)TRS005獲得臨床批件,并已啓動Ⅰ期臨床研究,拟用(yòng)于複發難治型非霍奇金氏淋巴瘤。
TRS005為(wèi)國(guó)家1類創新(xīn)藥物(wù),該品種已獲國(guó)家十二五、十三五“重大新(xīn)藥創制”專項滾動支持,并已申請三項中(zhōng)國(guó)專利和一項PCT國(guó)際專利。TRS005在臨床前動物(wù)腫瘤模型中(zhōng)展現了十分(fēn)出色的腫瘤抑制作(zuò)用(yòng),療效是重磅級單抗藥物(wù)的8倍以上,同時在相對劑量使用(yòng)上擁有(yǒu)較好的安(ān)全性,極具(jù)應用(yòng)前景。
無論國(guó)内還是國(guó)外,ADC藥物(wù)研發賽道火熱,其市場空間龐大。據中(zhōng)金公(gōng)司發布的研究報告,整個ADC藥物(wù)市場有(yǒu)望超過500億美元。誰能(néng)在這一賽道拔得頭籌,拭目以待。
----------THE END----------
免責聲明:本文(wén)系轉載分(fēn)享,文(wén)章觀點、内容、圖片及版權歸原作(zuò)者所有(yǒu),如涉及侵權請聯系删除!