2021年4月1日,美國(guó)費城兒童醫(yī)院癌症中(zhōng)心的Theodore W. Laetsch博士在《CA: A Cancer Journal for Clinicians》上發表了一篇名(míng)為(wèi)“Recent Progress in the Treatment of Cancer in Children”的綜述。該篇綜述介紹了近年來對兒童癌症治療産(chǎn)生影響的分(fēn)子靶向藥物(wù)和免疫治療的最新(xīn)進展。由于許多(duō)兒童癌症的治療強度已達到極限,因此近年來癌症兒童預後方面進步的步伐有(yǒu)所放緩。此外,随着兒童癌症幸存者數量的增加,治療的長(cháng)期副作(zuò)用(yòng)日益明顯。因此,人們的注意力轉移到使用(yòng)分(fēn)子靶向藥物(wù)和免疫療法,以改善未經傳統細胞毒性化療治愈的兒童的預後,減少細胞毒化療的暴露和後期影響。

自從1940年代和50年代首次進行白血病化療臨床試驗以來,兒童癌症治療取得了重大進展。今天,估計80%以上的兒童癌症可(kě)得到治愈。在2000年代之前,生存率的改善主要是因為(wèi)治療的強化,特别是對高危患者亞群,以及支持性護理(lǐ)的進步。近年來,兒童癌症生存率的提高速度有(yǒu)所減緩,并且随着靶向小(xiǎo)分(fēn)子和免疫治療劑的可(kě)用(yòng)性增加,除了細胞毒化療或替代細胞毒化療外,兒童癌症臨床試驗的重點越來越轉向結合使用(yòng)這兩種藥物(wù)。随着對兒童癌症治療後期影響的認識增加,進一步促進了這種轉變。蒽環類藥物(wù)導緻心肌病、烷基化劑導緻性腺功能(néng)紊亂以及拓撲異構酶抑制劑、烷基化劑和輻射等慢性毒性導緻繼發惡性腫瘤的風險增加。超過一半的兒童癌症幸存者經曆了癌症及其嚴重的治療長(cháng)期影響。因此,最近的幾項研究評估了降低低風險患者亞群的治療強度,并開始嘗試用(yòng)靶向療法替代細胞毒療法。然而,随着靶向治療的使用(yòng)越來越多(duō),研究人員也逐漸了解了這些藥物(wù)的慢性毒性。
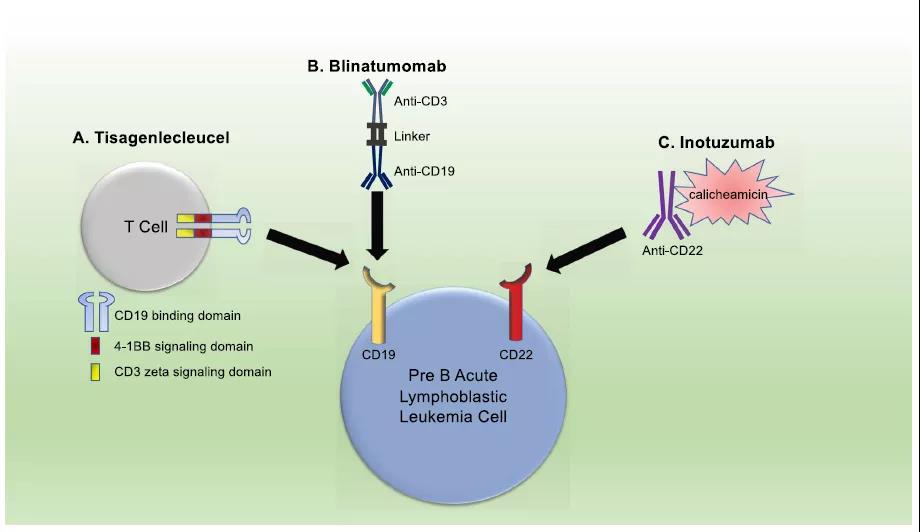
首先介紹的是各種兒童血液系統惡性腫瘤的藥物(wù)應用(yòng)。B細胞急性淋巴細胞白血病(B‐ALL)是兒科(kē)最常見的癌症,治愈率>90%。B‐ALL患兒預後改善的主要原因是診斷時風險分(fēn)層的進展以及對複發風險較高的患兒提前細胞毒性化療的升級。從曆史上看,那些經曆過B-ALL複發的兒童盡管接受了強烈的化療,但預後較差,通常随後是異基因幹細胞移植(alloSCT)。在兒科(kē)癌症中(zhōng)新(xīn)藥物(wù)的研究很(hěn)常見,考慮到未知的療效和毒性特征,新(xīn)療法通常首先在複發環境中(zhōng)進行研究。然而,一般的範例是将成功的藥物(wù)推進到一線(xiàn)治療,而非保留它們作(zuò)為(wèi)二線(xiàn)或三線(xiàn)藥物(wù)使用(yòng)。除了激酶抑制劑的使用(yòng),最近治療B細胞白血病的進展主要集中(zhōng)在直接針對B細胞的免疫治療劑的開發上。細胞表面标志(zhì)物(wù)如CD19、CD20和CD22的表達主要局限于正常B細胞和B-ALL腫瘤細胞。以腫瘤細胞為(wèi)靶點的治療方法徹底改變了對複發性和難治性(R/R)B-ALL患者的治療。在此介紹3種最近美國(guó)食品和藥物(wù)管理(lǐ)局(FDA)批準的治療小(xiǎo)兒B-ALL的免疫靶向療法:Tisagenlecleucel和Blinatumomab靶向CD19;Inotuzumab靶向CD22(圖1)。Tisagenlecleucel是一種基于自體(tǐ)嵌合抗原受體(tǐ)(CAR)T細胞的療法。将CD19結合到B‐ALL細胞的表面後,細胞内4‐1BB和CD3ζ信号傳導域會導緻針對B‐ALL的細胞毒性以及Tisagenlecleucel的增殖和持久性;Blinatumomab是一種雙特異性T細胞銜接子,由抗CD3抗體(tǐ)片段組成,該片段結合通過接頭連接的T細胞與抗CD19抗體(tǐ)片段,後者又(yòu)與B‐ALL細胞結合。結合後,T細胞被激活以誘導針對B‐ALL細胞的細胞毒性;Inotuzumab是一種抗體(tǐ)-藥物(wù)偶聯物(wù)(ADC),包含抗CD22抗體(tǐ)片段,該片段結合B-ALL細胞和加利車(chē)黴素。
 <
<
盡管與接受化療和alloSCT治療的患者相比,接受CAR T細胞治療的患者副作(zuò)用(yòng)較少,但必須密切監測其獨特的毒性,包括細胞因子釋放綜合征(CRS)、神經毒性和B細胞再生障礙。當CAR T細胞擴張并激活免疫系統,導緻炎症細胞因子的釋放。ELIANA試驗中(zhōng)有(yǒu)47%的患者出現嚴重(3級或4級)的CRS,症狀包括發熱、缺氧和低血壓。CRS的嚴重程度與患者的疾病負擔相關,而在輸注時疾病水平較低的患者中(zhōng),報告的發病率較低。神經毒性通常與CRS合并發生,盡管病因尚不清楚。在ELIANA試驗中(zhōng),13%的患者出現嚴重(3級)神經毒性,症狀包括頭痛、腦病和失語症,但在大多(duō)數情況下是可(kě)逆的。盡管神經毒性患者得到了支持性治療,嚴重CRS患者對IL-6抑制劑托西立單抗和皮質(zhì)類固醇的治療反應良好。CD19 CAR T細胞治療最常見的長(cháng)期毒性是B細胞再生障礙。這是一種靶向不良反應,因為(wèi)CAR細胞攻擊正常的表達CD19的B細胞,并且可(kě)以持續數年,但通過靜脈注射免疫球蛋白可(kě)以有(yǒu)效控制。
大約15%的急性淋巴細胞白血病(ALL)患兒有(yǒu)T細胞ALL(T-ALL)。從曆史上看,與B-ALL患者相比,T-ALL患者的無事件生存率(EFS)和總體(tǐ)存活率(OS)較低,因為(wèi)T-ALL患者通常具(jù)有(yǒu)高風險的臨床特征。然而,強化治療和改善對T-ALL患兒進行細胞毒性化療的最佳方案的了解提高了治愈率,最近一項随機研究的上半部分(fēn)報道了93.7%的5年生存率。但T-ALL患者初次治療後複發的有(yǒu)效治療選擇有(yǒu)限,3年EFS率<25%。雖然免疫治療已經徹底改變了R/R B-ALL兒童的治療,但T-ALL患者類似治療方法的發展滞後,主要是因為(wèi)缺乏區(qū)分(fēn)惡性T淋巴細胞和正常T細胞的特異性靶點。因此,正在早期引入奈拉濱和硼替佐米兩種新(xīn)藥,以确定它們能(néng)否改善EFS和OS。奈拉濱是抗代謝(xiè)藥物(wù):一種抑制DNA合成的核苷類似物(wù)。已發現在極低濃度下對T淋巴細胞具(jù)有(yǒu)特異性細胞毒性。随機接受奈拉濱治療的患者生存率提高,4年EFS率為(wèi)89%,而未接受奈拉濱治療的患者為(wèi)83%。鑒于EFS的改善和顯著的總體(tǐ)結果,奈拉濱現在被認為(wèi)是該人群的标準治療。硼替佐米是一種蛋白酶體(tǐ)抑制劑,可(kě)選擇性抑制26S蛋白酶體(tǐ),從而抑制參與細胞周期調節、轉錄因子激活和凋亡的蛋白質(zhì)的降解。臨床前研究表明硼替佐米可(kě)能(néng)使耐類固醇的T-ALL細胞對皮質(zhì)類固醇敏感,皮質(zhì)類固醇是T-ALL治療的基石。
急性髓細胞白血病(AML)約占兒童白血病的25%。AML的治療包括4到5個療程的強化骨髓抑制化療,包括蒽環類藥物(wù)和大劑量阿糖胞苷(有(yǒu)或沒有(yǒu)alloSCT)。盡管AML兒童的存活率現在已經接近60%,但是那些無法通過一線(xiàn)治療治愈的兒童和複發的兒童的預後很(hěn)差。傳統上,對于患者的R / R AML治療方案包括類似的常規的化學(xué)治療劑,接着alloSCT。盡管蒽環類藥物(wù)是治療和長(cháng)期治愈AML兒童的基本要素,但其使用(yòng)受到心髒毒性的限制,這最終可(kě)能(néng)導緻嚴重的長(cháng)期影響,包括心力衰竭。近來,脂質(zhì)體(tǐ)化學(xué)治療劑的使用(yòng)已顯示出有(yǒu)望作(zuò)為(wèi)限制心髒毒性同時保持或增強功效的策略。當将脂質(zhì)體(tǐ)柔紅黴素(DaunoXome; Gilead Science)添加到标準化學(xué)療法的骨幹中(zhōng)時,對複發性AML兒童的抑制率更高。抗凋亡BCL-2家族蛋白的過度表達是AML化療耐藥的一個已知機制, Venetoclax是BCL2的選擇性抑制劑,可(kě)誘導AML細胞系凋亡,在促進癌細胞死亡方面具(jù)有(yǒu)良好的臨床前療效。FLT3基因突變是AML中(zhōng)常見的體(tǐ)細胞事件,導緻FLT3受體(tǐ)酪氨酸激酶過度激活,細胞增殖失控。曆史上,被診斷為(wèi)FLT3陽性AML的兒童預後較差,常規化療的OS率僅約為(wèi)20%至30%。小(xiǎo)分(fēn)子FLT3激酶抑制已成為(wèi)藥物(wù)開發的一個活躍領域。COG AAML1031試驗評估了在标準多(duō)藥化療中(zhōng)添加索拉非尼對新(xīn)診斷的FLT3/ITD陽性AML患者的安(ān)全性和有(yǒu)效性。經過第二輪誘導後,化療加索拉非尼組的完全緩解(CR)率為(wèi)91%,而單純化療組的CR率為(wèi)70%(P=0.007)。接受化療加索拉非尼組的三年EFS為(wèi)57.5%,單純化療組為(wèi)34.3%。盡管結果喜人,但有(yǒu)許多(duō)非靶向效應導緻毒性增加,最顯著的是皮膚毒性。Quizartinib是第二代FLT3抑制劑,臨床前證據表明其效力和選擇性有(yǒu)所提高,目前正在COG AAML1831治療研究中(zhōng)作(zuò)為(wèi)前期治療進行研究。Gemtuzumab‐ozogamicin(GO)是一種針對細胞表面抗原CD33的抗體(tǐ)藥物(wù)偶聯物(wù)(ADC),其存在于>80%的AML細胞上,但在多(duō)能(néng)幹細胞中(zhōng)不存在。COG AAML0531研究表明,标準化療中(zhōng)加入GO可(kě)降低兒童和青少年AML的複發率,從而改善EFS。盡管靶向腫瘤相關抗原的CAR T細胞在B-ALL患者的治療中(zhōng)顯示出巨大前景,但由于難以确定對AML細胞具(jù)有(yǒu)高度特異性的抗原,從而限制了針對AML兒童的類似治療進展。而這種抗原在正常造血幹細胞上并不存在,因此不會導緻難以接受的骨髓毒性。盡管如此,仍有(yǒu)許多(duō)臨床前的CAR-T細胞正在被開發用(yòng)于治療AML,有(yǒu)些細胞剛剛到達臨床。類似地,雙特異性T細胞銜接子Flotetuzumab可(kě)識别大多(duō)數AML細胞表面的CD123和正常T細胞表面的CD3,已在成人難愈性AML患者中(zhōng)有(yǒu)應答(dá),目前正在兒童中(zhōng)進行臨床試驗。
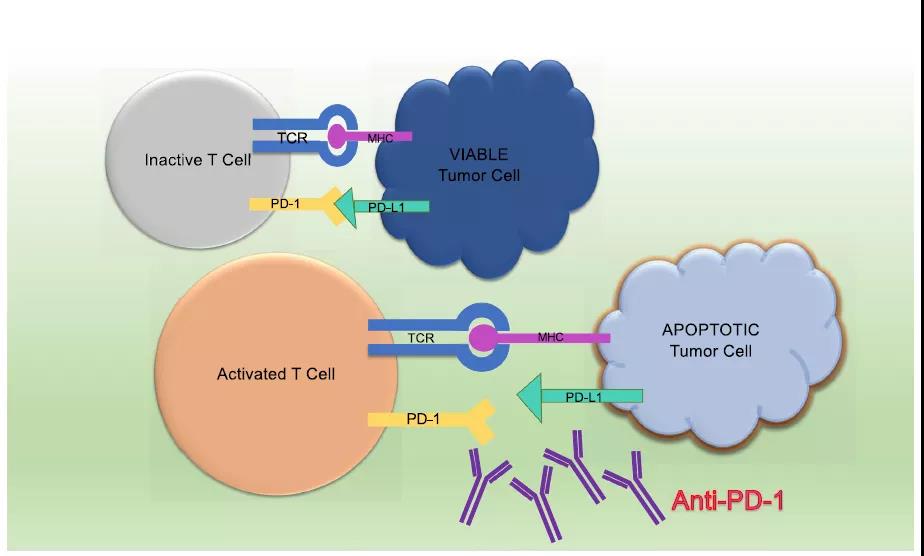
霍奇金淋巴瘤(HL)是15-18歲青少年最常見的惡性腫瘤。傳統上,HL的一線(xiàn)治療包括在有(yǒu)或沒有(yǒu)放射治療的情況下對受累部位進行多(duō)藥化療。多(duō)模式治療下5年OS率>90%。在HL幸存者中(zhōng),繼發性惡性腫瘤、性腺和非性腺内分(fēn)泌功能(néng)障礙以及治療相關心血管疾病的風險增加。值得注意的是,在治療期間接受放療的患者中(zhōng),繼發性惡性腫瘤的風險特别高。最近的治療試驗的重點是盡量減少後期影響,同時使用(yòng)基于風險和反應适應的治療保持出色的療效。盡管HL患者的OS很(hěn)好,但對于進行性和/或複發性疾病患者的标準二線(xiàn)化療方案包括與顯著治療相關的毒性或繼發性惡性腫瘤相關的治療,強調需要新(xīn)的治療方法。Brentuximab vedotin是一種ADC,靶向HL細胞上的CD30細胞表面受體(tǐ),并在内化後釋放微管抑制劑vedotin。它已被批準用(yòng)于治療既往化療失敗的R/R典型HL成年患者治療。最近的臨床前研究也表明,HL細胞增加了免疫抑制PD-1配體(tǐ)的表達,這可(kě)能(néng)是免疫逃避的機制。在正常條件下,免疫抑制配體(tǐ)PD-L1和PD-L2與PD-1結合,終止活化T細胞的反應。這可(kě)以克服針對癌細胞的T細胞免疫監視并促進腫瘤進展。Pembrolizumab是一種單克隆抗體(tǐ),可(kě)阻斷PD-1與其配體(tǐ)的結合,有(yǒu)可(kě)能(néng)恢複免疫監測(圖2)。Pembrolizumab在多(duō)種腫瘤類型的成年患者中(zhōng)顯示出強大的抗腫瘤活性和良好的安(ān)全性。2017年,FDA批準Pembrolizumab加速治療兒童R/R HL。
 <
<
非霍奇金淋巴瘤(NHL)是指成熟淋巴樣細胞癌,并進一步細分(fēn)為(wèi)成熟B細胞或T細胞NHL。在兒童中(zhōng),成熟B細胞NHL(B-NHL)最常見,主要包括Burkitt淋巴瘤,彌漫性大B細胞淋巴瘤和原發性縱隔B細胞淋巴瘤。非霍奇金淋巴瘤患者常表現為(wèi)晚期,但他(tā)們對化療的反應非常好,治愈率>90%。目前,晚期非霍奇金淋巴瘤兒童的護理(lǐ)标準包括利妥昔單抗聯合細胞毒性化療。利妥昔單抗是一種抗CD20的抗體(tǐ),在成熟的B細胞(包括B-NHL)的表面表達。一項針對III期或IV期B-NHL患者的随機3期試驗中(zhōng),接受利妥昔單抗聯合化療的患者3年EFS率為(wèi)94%,OS率為(wèi)95%,而單獨化療的患者分(fēn)别為(wèi)82%和87%。盡管患有(yǒu)非霍奇金淋巴瘤的兒童患者有(yǒu)很(hěn)高的治愈率,但那些複發的患者預後很(hěn)差。顯然,需要新(xīn)的治療方法來改善預後和降低毒副作(zuò)用(yòng)。2018年,Pembrolizumab被FDA批準用(yòng)于治療多(duō)發複發或難治性原發性縱隔B細胞淋巴瘤(一種B-NHL亞型)的成人和兒童患者。2項成人患者療效研究的有(yǒu)效率分(fēn)别為(wèi)48%和45%。
間變性大細胞淋巴瘤(ALCL)是一種T細胞淋巴瘤,不太常見,占兒童NHL病例的10%至15%。例接受化療的ALCL患兒EFS率約為(wèi)70%。在兒童中(zhōng),90%的患者有(yǒu)間變性淋巴瘤激酶基因(ALK)易位,産(chǎn)生編碼組成性活性ALK激酶并導緻不受控制的細胞增殖的緻癌融合蛋白。有(yǒu)兩類治療兒童ALCL的靶向藥物(wù)正在研究中(zhōng):小(xiǎo)分(fēn)子ALK抑制劑和靶向CD30的ADC,CD30是ALCL細胞上的一種表面抗原。在一項用(yòng)ALK抑制劑克唑替尼治療的ALK陽性R / R ALCL的兒科(kē)患者的1/2期研究中(zhōng),> 80%的患者獲得了CR。類似地,第二代ALK抑制劑賽立替尼的應答(dá)率非常高。一項針對R/R ALCL患者的多(duō)中(zhōng)心1/2期研究,以CD30為(wèi)靶點的ADC-brentuximab-vedotin在治療中(zhōng)表現出53%的ORR,包括41%的CRs。基于這兩種藥物(wù)對複發性ALCL的陽性反應率,一項正在進行的一線(xiàn)臨床試驗将新(xīn)診斷的ALCL患兒随機分(fēn)為(wèi)兩組,一組是克立唑替尼組,另一組是布倫妥昔單抗-韋多(duō)汀組,另一組是聯合化療組(臨床試驗.gov标識符NCT01979536)。
除了兒童血液系統惡性腫瘤用(yòng)藥發展,還有(yǒu)兒童實體(tǐ)瘤。神經母細胞瘤是兒童最常見的顱外實體(tǐ)瘤,發病年齡中(zhōng)位數為(wèi)19個月。通常見于腎上腺或後交感神經鏈。患者因素(年齡和分(fēn)期)和腫瘤基因組學(xué)對風險分(fēn)層都至關重要。年齡小(xiǎo)于18個月的兒童即使患有(yǒu)轉移性疾病,預後也比較好。年齡>18個月的轉移性疾病(M期神經母細胞瘤)患兒5年的EFS僅接近50%。80例MYCN基因擴增或染色體(tǐ)片段改變(包括1p和11q缺失)的患者預後更差。最近,随着下一代測序(NGS)應用(yòng)的增加,其他(tā)體(tǐ)細胞改變,包括ATRX突變和ARID1A或ARID1B基因缺失,都與不良預後有(yǒu)關。通過一系列研究強化治療的試驗,高危疾病兒童的預後逐漸改善。目前,美國(guó)對此類患者的标準治療包括5到6個周期的化療、手術切除、2次自體(tǐ)SCT、放療和免疫治療。這種高強度的治療方案會導緻常見的治療毒性,如聽力損失、腎小(xiǎo)球濾過率降低和内分(fēn)泌疾病,包括生長(cháng)遲緩和性腺功能(néng)障礙。神經節苷脂(如GD2)是在外周神經元、皮膚黑素細胞和中(zhōng)樞神經系統的細胞外膜上發現的糖脂。對神經母細胞瘤細胞的研究表明GD2的表達水平很(hěn)高,每個神經母細胞瘤細胞平均有(yǒu)500萬到1000萬分(fēn)子,使GD2成為(wèi)神經母細胞瘤的一個有(yǒu)吸引力的免疫治療靶點。鑒于GD2的高表達水平,已經在臨床試驗中(zhōng)測試了抗GD2的單克隆抗體(tǐ)(圖3),包括小(xiǎo)鼠3F8,這是一種抗GD2的單克隆抗體(tǐ),在1/2期試驗中(zhōng)證明了安(ān)全性、耐受性和有(yǒu)效性,具(jù)有(yǒu)預期的疼痛副作(zuò)用(yòng),高血壓和過敏反應。GD2抗體(tǐ)治療神經母細胞瘤。dinutuximab和dinutuximabβ是靶向成神經細胞瘤細胞表面GD2的單克隆抗體(tǐ)。同時施用(yòng)細胞因子粒細胞-單核細胞集落刺激因子(GM-CSF),以刺激先天免疫系統,識别和破壞被抗GD2包裹的成神經細胞瘤細胞。在通過COG進行的随機3期試驗後,在自體(tǐ)造血幹細胞移植術後高危神經母細胞瘤患兒的維持治療中(zhōng),鼠人嵌合抗體(tǐ)dinutuximab聯合IL-2和GM-CSF聯合異維甲酸治療優于單用(yòng)異維甲酸治療。2年EFS率為(wèi)66%,而單用(yòng)異維甲酸組為(wèi)46%, FDA于2015年批準dinutuximab用(yòng)于高危神經母細胞瘤治療。停止治療4年後的随訪數據繼續顯示OS顯著改善。在中(zhōng)國(guó)倉鼠卵巢細胞中(zhōng)開發的一種不同的産(chǎn)品,dinutuximabβ(不是嵌合的人/小(xiǎo)鼠dinutuximab),已在歐洲類似的随機試驗中(zhōng)進行了研究,結果具(jù)有(yǒu)可(kě)比性。假設半乳糖旋轉溶解導緻許多(duō)過敏反應,因為(wèi)抗α半乳糖是人類最豐富的天然免疫球蛋白,但dinutuximabβ不經曆這一過程。在HR-NBL1試驗中(zhōng),dinutuximabβ的過敏反應較少(臨床試驗.gov标識符NCT01704716)。
 <
<
骨肉瘤是一種主要出現在長(cháng)骨幹骺端的骨腫瘤,具(jù)有(yǒu)雙峰年齡分(fēn)布,第一個峰值出現在10-14歲的兒童,占兒童惡性腫瘤的2%。骨肉瘤的特征是其基因組比許多(duō)其他(tā)兒童癌症複雜得多(duō),包括幾乎普遍的TP53失活和複雜的結構重排。然而,檢查點免疫療法試驗中(zhōng),例如使用(yòng)PD-1抑制劑pembrolizumab調查,已經令人失望,盡管它在許多(duō)成人腫瘤特征在于高突變負擔(通常是單核苷酸多(duō)态性,而不是結構變化)活性。在骨肉瘤患者中(zhōng)的一些試驗研究了複發環境中(zhōng)的多(duō)激酶抑制劑,一項針對年齡≥18歲患者的随機研究顯示,雷戈拉非尼與安(ān)慰劑相比可(kě)延長(cháng)無進展生存期。法國(guó)肉瘤組進行的多(duō)中(zhōng)心CABONE研究(臨床試驗.gov标識符NCT02243605)研究了另一種多(duō)激酶抑制劑卡波紮尼的使用(yòng),同時患有(yǒu)尤文(wén)肉瘤和骨肉瘤的患者。在骨肉瘤組的32名(míng)可(kě)評估患者中(zhōng),12%的患者有(yǒu)客觀的部分(fēn)應答(dá),而33%的患者在6個月時沒有(yǒu)疾病進展。
尤文(wén)氏肉瘤是兒童中(zhōng)第二常見的骨惡性腫瘤,其特征是EWSR1和E-26轉化特異性(ETS)家族基因的平衡易位,90%的患者是FLI1。标準治療包括以壓縮方式施用(yòng)化療藥物(wù),高劑量-強度治療,許多(duō)患者經曆了顯著的長(cháng)期毒性,包括由于烷化劑和輻射導緻的生育能(néng)力下降和繼發惡性腫瘤。對于那些患有(yǒu)轉移性或R/R疾病的兒童,結果令人沮喪。與骨肉瘤相比,尤因肉瘤的突變負擔極低,将治療靶标限制在EWSR1-ETS轉錄因子或其下遊靶标之外。對轉錄因子進行藥物(wù)處理(lǐ)的困難限制了直接靶向EWS-FLI1。然而,TK216抑制EWS-FLI1蛋白與尤文(wén)氏肉瘤緻癌性的關鍵介質(zhì)RNA解旋酶A之間的相互作(zuò)用(yòng),在臨床前研究中(zhōng)顯示出了希望,目前正在一項1期試驗中(zhōng)進行研究(臨床試驗.gov标識符NCT02657005 )。
橫紋肌肉瘤(RMS)是小(xiǎo)兒最常見的軟組織肉瘤,組織學(xué)上與骨骼肌成肌細胞相似。風險分(fēn)層是基于原發腫瘤的部位、手術切除的範圍、轉移的存在和腫瘤基因組學(xué)。從遺傳學(xué)上講,RMS被分(fēn)離為(wèi)融合陽性(FP)疾病,其特征是PAX-FOXO1之間存在平衡易位,這與較差的預後相關,缺乏這種易位的融合陰性(FN)疾病。例非轉移性FN-RMS患兒完全從有(yǒu)利解剖部位切除,疾病風險低,5年無病生存率接近90%。然而,即使缺乏PAX-FOXO1易位的患者,廣泛轉移性疾病(高危RMS)患者的預後也很(hěn)差。大多(duō)數其他(tā)患者,包括局限性FP病患者和局限性FN病患者在不利部位的預後中(zhōng)等。與尤因肉瘤類似,假設FP-RMS中(zhōng)的PAX-FOXO1易位可(kě)驅動腫瘤發生和腫瘤生存,并且這些腫瘤很(hěn)少有(yǒu)額外的體(tǐ)細胞突變。或者,FN-RMS經常在與細胞周期進展和生存相關的基因中(zhōng)存在多(duō)個突變和拷貝數改變,例如NF1、FGFR4、CDKN2A、PI3KCA和RAS蛋白家族。确定這種基因異質(zhì)性惡性腫瘤的新(xīn)療法是個挑戰,尤其是在R/R疾病患者中(zhōng)。盡管如此,通過諸如兒科(kē)分(fēn)子分(fēn)析治療選擇(MATCH)等研究(臨床試驗.gov标識符NCT03155620)和INFORM試驗研究正在努力評估針對這些改變的靶向治療。
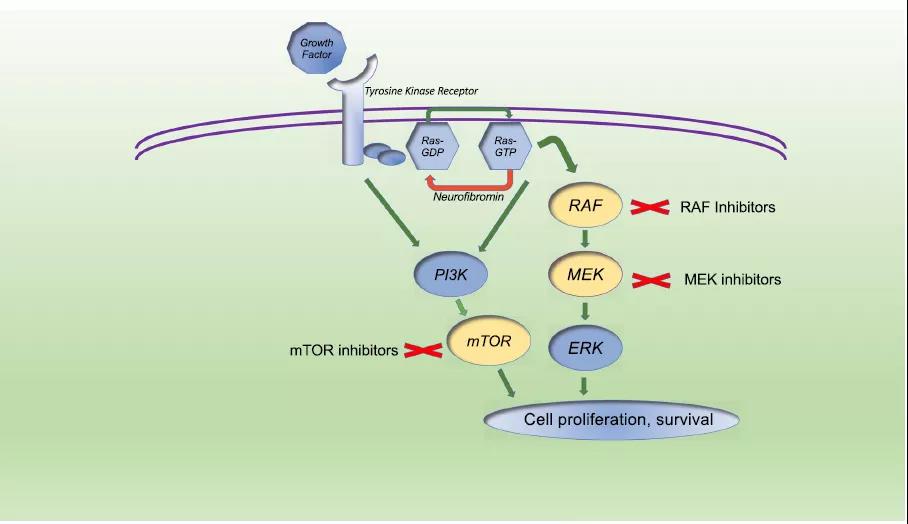
小(xiǎo)兒中(zhōng)樞神經系統腫瘤是小(xiǎo)兒實體(tǐ)瘤中(zhōng)最常見的惡性腫瘤。最常見的惡性腫瘤包括髓母細胞瘤、室管膜瘤和高級别膠質(zhì)瘤,而最常見的良性腫瘤是低級别膠質(zhì)瘤(LGGs),尤其是毛細胞星形細胞瘤。其他(tā)腫瘤亞型,如非典型畸胎樣/橫紋肌樣腫瘤、彌漫性腦橋膠質(zhì)瘤以及垂體(tǐ)和脊神經的其他(tā)惡性腫瘤,發生的頻率較低。在過去20年中(zhōng),大多(duō)數此類癌症患者的臨床結局一直處于平穩狀态。然而,最近在了解兒童中(zhōng)樞神經系統腫瘤方面的進展是由于評估每個腫瘤亞型内複雜的遺傳景觀,導緻世界衛生組織在2016年根據遺傳和分(fēn)子特征重新(xīn)分(fēn)類這些惡性腫瘤。LGG占了近三分(fēn)之一的兒童中(zhōng)樞神經系統腫瘤。總的來說,LGG患兒的OS非常好,完全切除通常可(kě)以長(cháng)期治愈。對于手術切除不可(kě)行的患者,往往需要随後的進展和進一步治療。先前的治療包括局部放療和/或常規化療,兩者都具(jù)有(yǒu)潛在的長(cháng)期後果。突破性的兒童LGG全基因組測序已确定Ras‐Raf‐MEK‐ERK信号級聯中(zhōng)的多(duō)種改變,并已明确确定該信号通路中(zhōng)的異常是兒科(kē)LGG發展的基礎。這種對Ras‐Raf‐MEK‐ERK信号級聯改變作(zuò)用(yòng)的鑒定為(wèi)兒童期進行性LGG開辟了新(xīn)的靶向治療選擇(圖4)。兒科(kē)神經膠質(zhì)瘤的靶向治療,PI3K / mTOR和Ras / ERK信号轉導的激活通過信号轉導組件(例如raf,受體(tǐ)酪氨酸激酶FGF)的激活突變或神經纖維蛋白(NF1)的丢失而導緻下遊組件激活,細胞生長(cháng)和腫瘤形成。靶向抑制劑可(kě)用(yòng)于阻斷突變變體(tǐ)(BRAF)或下遊成分(fēn)(MEK和/或mTOR)的激活(黃色标記)。使用(yòng)MEK抑制劑selumetinib治療複發性LGG患者的兒科(kē)腦腫瘤聯合研究顯示,該藥具(jù)有(yǒu)很(hěn)好的活性,部分(fēn)應答(dá)率為(wèi)20%至40%,并且在腫瘤顯示Ras-Raf-MEK-ERK通路激活突變的患者中(zhōng),應答(dá)率最高,包括體(tǐ)細胞BRAF改變(BRAF V600E和BRAF融合)以及種系神經纖維瘤病1型(NF1)。MEK抑制劑曲美替尼也有(yǒu)類似的反應。盡管MEK抑制劑單一療法具(jù)有(yǒu)活性,患有(yǒu)BRAF V600E突變的腫瘤患者可(kě)能(néng)從BRAF抑制中(zhōng)獲益最大。在這些患者中(zhōng),使用(yòng)BRAF抑制劑達布拉非尼的單藥治療在1/2期試驗中(zhōng)顯示ORR為(wèi)44%,使用(yòng)達布拉非尼和曲美替尼聯合治療的有(yǒu)限病例組顯示出顯著的單一患者反應 (臨床試驗.gov标識符NCT02684058)。
 <
<
過去的5年裏,常規使用(yòng)NGS分(fēn)子鑒定兒童癌症已成為(wèi)可(kě)能(néng)。在一些研究中(zhōng),大約25%到50%的兒童腫瘤被報道具(jù)有(yǒu)潛在的靶向性分(fēn)子改變。然而,在大多(duō)數研究中(zhōng),強有(yǒu)力的臨床證據支持這種治療益處的實體(tǐ)瘤患者比例<5%。為(wèi)解決這一局限性,多(duō)個正在進行的臨床試驗正在以組織學(xué)不可(kě)知的方式研究與分(fēn)子改變相匹配的治療益處。最近FDA批準了檢查點抑制劑和分(fēn)子靶向療法,用(yòng)于以組織學(xué)不可(kě)知的方式治療兒童癌症,這突出了這種方法的前景。在成人腫瘤學(xué)中(zhōng),檢查點抑制劑已獲得FDA的批準,用(yòng)于治療各種組織學(xué)疾病,特别是典型的具(jù)有(yǒu)較高突變負擔的上皮癌。盡管人們對兒童癌症寄予厚望,但目檢查點抑制劑的臨床試驗在HL以外的兒童中(zhōng)的療效有(yǒu)限。使用(yòng)PD-1抑制劑pembrolizumab治療的136名(míng)診斷為(wèi)非HL的可(kě)評估兒童中(zhōng),63名(míng)客觀有(yǒu)效率為(wèi)6%,而在使用(yòng)PD-1抑制劑nivolumab治療的85名(míng)非淋巴瘤實體(tǐ)瘤兒童中(zhōng),沒有(yǒu)客觀有(yǒu)效率。同樣,在這些兒童中(zhōng),隻有(yǒu)單一客觀有(yǒu)效率78例接受PD-L1抑制劑阿替唑珠單抗治療的非淋巴瘤實體(tǐ)瘤患兒。這些低應答(dá)率可(kě)能(néng)是由于大多(duō)數兒童癌症的突變負擔低于許多(duō)成人上皮性癌症。迄今為(wèi)止,針對實體(tǐ)瘤兒童的兩種最成功的分(fēn)子靶向療法是larotrectinib和entrectinib,它們可(kě)抑制神經營養性酪氨酸受體(tǐ)激酶(NTRK)融合陽性惡性腫瘤中(zhōng)的TRKA,TRKB和TRKC。NTRK融合跨越多(duō)種癌症的發生,但在兒童,被最常鑒定小(xiǎo)兒軟組織肉瘤,最明顯的是嬰兒纖維肉瘤。Larotrectinib是第一個獲得FDA批準的治療兒童和成人TRK融合陽性實體(tǐ)瘤的組織學(xué)不可(kě)知藥物(wù)。類似地,entrectinib是一種具(jù)有(yǒu)抗TRK、ALK和ROS1活性的多(duō)激酶抑制劑,在NTRK重排、ALK重排和ROS1重排的實體(tǐ)惡性腫瘤(包括肉瘤和中(zhōng)樞神經系統腫瘤)患者中(zhōng)顯示出良好的前景,在患有(yǒu)廣泛TRK融合實體(tǐ)瘤的成年患者中(zhōng),ORR為(wèi)57%。、盡管青少年和兒童患者的1/2期研究(STARTRK-NG)仍在進行中(zhōng)(臨床試驗.gov标識符NCT02650401),entrectinib也獲得了組織學(xué)不可(kě)知的批準,用(yòng)于治療年齡≥12歲的TRK融合實體(tǐ)瘤。雖然目前沒有(yǒu)一種激酶抑制劑獲得了對兒童癌症的監管批準,但其他(tā)幾種激酶抑制劑已證明在兒童中(zhōng)具(jù)有(yǒu)多(duō)種組織學(xué)活性,包括用(yòng)于ALK融合陽性腫瘤的ALK抑制劑,用(yòng)于RET突變和RET融合驅動的癌症的selpercatinib (已批準用(yòng)于≥12歲的患有(yǒu)RET改變的甲狀腺癌的患者);BRAF抑制劑用(yòng)于攜帶BRAF V600E突變的腫瘤。考慮到少數患者患有(yǒu)每種個體(tǐ)突變的腫瘤,開發這些針對兒童的分(fēn)子靶向藥物(wù)是一項跨越多(duō)個國(guó)家和地區(qū)的國(guó)際性努力。
盡管兒童癌症的治療取得了重大進展,但仍然是美國(guó)兒童和年輕人死亡的主要原因之一。在過去的幾十年中(zhōng),細胞毒性化療方案的強化已經顯著改善了治療結果;然而,在治療R/R疾病的兒童方面仍然存在差距,幸存者會遭受化療誘導的長(cháng)期影響和發病率。随着靶向藥物(wù)和免疫治療藥物(wù)數量的迅速增加以及對兒童惡性腫瘤分(fēn)子機制的進一步了解,人們的注意力已經轉向開發針對這些機制途徑、遺傳畸變和免疫治療靶點的靶向治療。這種精(jīng)确治療方法在一些R/R癌症患者中(zhōng)表現出了顯著的活性,并朝着将這些藥物(wù)作(zuò)為(wèi)前期治療的組成部分(fēn)的研究邁出了新(xīn)的一步。盡管許多(duō)新(xīn)藥的長(cháng)期作(zuò)用(yòng)才剛剛開始評估,但希望這些治療方法有(yǒu)可(kě)能(néng)提高治愈率并降低治療的後期影響。
----------THE END----------
免責聲明:本文(wén)系轉載分(fēn)享,文(wén)章觀點、内容、圖片及版權歸原作(zuò)者所有(yǒu),如涉及侵權請聯系删除!