摘要
新(xīn)冠疫情的持續凸顯了疫苗的重要性以及全球對疫苗的迫切需求。借此契機,mRNA疫苗登上了舞台,并以極高的保護率成為(wèi)所有(yǒu)新(xīn)冠疫苗種類中(zhōng)熱度最高的C位選擇。本報告介紹分(fēn)析了mRNA疫苗相較于其他(tā)技(jì )術路徑疫苗的優勢,mRNA疫苗的核心技(jì )術,以及未來的發展空間和方向。
目錄
前言mRNA疫苗:疫苗行業新(xīn)王朝的崛起
免疫系統及疫苗工(gōng)作(zuò)原理(lǐ)免疫系統概覽獲得性免疫作(zuò)用(yòng)原理(lǐ)疫苗一般性原理(lǐ)mRNA疫苗mRNA疫苗相較于其他(tā)技(jì )術路徑疫苗的優劣勢分(fēn)析
mRNA新(xīn)冠疫苗臨床數據解析:No pain, no gainmRNA疫苗展現了令人振奮的保護率mRNA疫苗不良反應:短期反應略高于傳統疫苗,需要時間驗證長(cháng)期安(ān)全性mRNA疫苗臨床數據特點:No pain,No gainmRNA疫苗嚴重/緻命性不良反應罕見但需關注
新(xīn)冠疫情為(wèi)mRNA疫苗登上舞台帶來機遇mRNA疫苗效果初顯,免疫屏障減緩病例新(xīn)增短期:國(guó)産(chǎn)mRNA疫苗應聚焦海外放量中(zhōng)長(cháng)期:病毒變異或削弱一代疫苗效力,mRNA疫苗可(kě)快速反應應對變異
mRNA疫苗生産(chǎn)流程第一步:DNA質(zhì)粒制備第二步:體(tǐ)外轉錄第三步:遞送系統裝(zhuāng)載第四步:灌裝(zhuāng)檢驗
mRNA疫苗兩大核心競争力:序列結構、遞送系統mRNA序列結構決定抗原蛋白結構、免疫原性及穩定性遞送系統是目前産(chǎn)能(néng)擴張的瓶頸
mRNA疫苗有(yǒu)望為(wèi)腫瘤免疫疾病控制帶來新(xīn)曙光mRNA疫苗屬性契合腫瘤免疫疾病控制需求mRNA疫苗能(néng)夠激發針對細胞的T細胞免疫mRNA疫苗能(néng)夠更精(jīng)準地靶向特異免疫目标mRNA腫瘤疫苗研發情況
投資策略:國(guó)内mRNA疫苗暫時空白,關注擁有(yǒu)核心技(jì )術的企業沃森生物(wù)複星醫(yī)藥
圖表目錄
圖表1:固有(yǒu)免疫和獲得性免疫系統
圖表2:初次感染與第二次感染抗體(tǐ)水平反應速度
圖表3:記憶免疫細胞的生成
圖表4:DNA轉錄mRNA轉譯蛋白質(zhì)過程
圖表5:胞吞作(zuò)用(yòng)及内含體(tǐ)逃逸
圖表6:脂質(zhì)體(tǐ)内含體(tǐ)幹擾原理(lǐ)
圖表7:BNT162b2有(yǒu)效保護率臨床數據
圖表8:mRNA-1273對18歲以上人群有(yǒu)效保護率臨床數據
圖表9:mRNA-1273對65歲及以上人群有(yǒu)效保護率臨床數據
圖表10:國(guó)藥集團新(xīn)冠滅活疫苗有(yǒu)效保護率臨床數據
圖表11:18-55歲人群兩次接種BNT162b2後各類不良反應發生概率
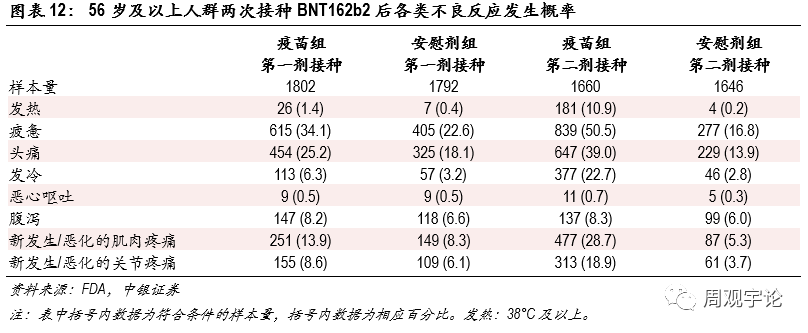
圖表12:56歲及以上人群兩次接種BNT162b2後各類不良反應發生概率
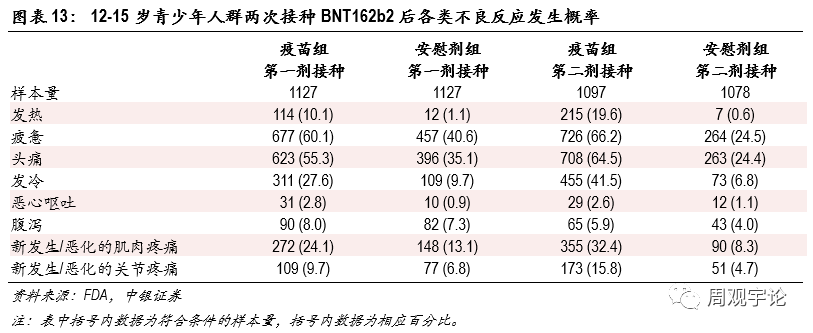
圖表13:12-15歲青少年人群兩次接種BNT162b2後各類不良反應發生概率
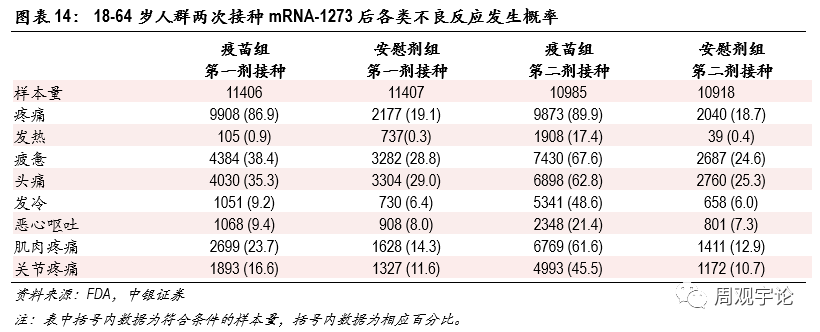
圖表14:18-64歲人群兩次接種mRNA-1273後各類不良反應發生概率
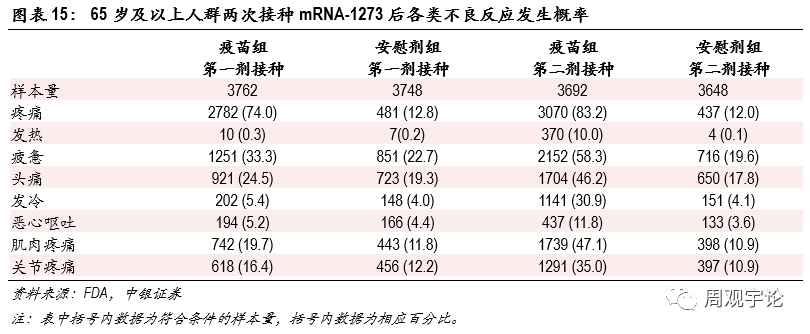
圖表15:65歲及以上人群兩次接種mRNA-1273後各類不良反應發生概率
圖表16:接種第一劑國(guó)藥集團新(xīn)冠滅活疫苗後0-28天各類不良反應發生概率
圖表17:mRNA疫苗與滅活疫苗各類不良反應發生概率對比
圖表18:mRNA疫苗與滅活疫苗有(yǒu)效保護率對比
圖表19:BNT162b2與mRNA1273對64歲以上人群有(yǒu)效保護率
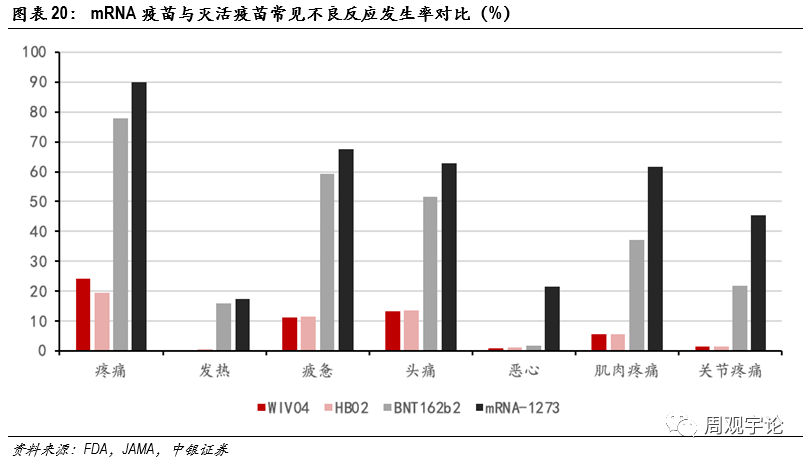
圖表20:mRNA疫苗與滅活疫苗常見不良反應發生率對比(%)
圖表21:美國(guó)每月新(xīn)增新(xīn)冠病例數(萬例)與疫苗接種情況
圖表22:國(guó)内(不包括港澳台)已上市新(xīn)冠疫苗
圖表23:全球及部分(fēn)國(guó)家每日新(xīn)增新(xīn)冠感染病例數(萬例)
圖表24:中(zhōng)國(guó)國(guó)内居民(mín)新(xīn)冠疫苗接種劑次
圖表25:輝瑞/BioNTech新(xīn)冠疫苗(BNT162b2)生産(chǎn)過程第一階段 - DNA質(zhì)粒制備
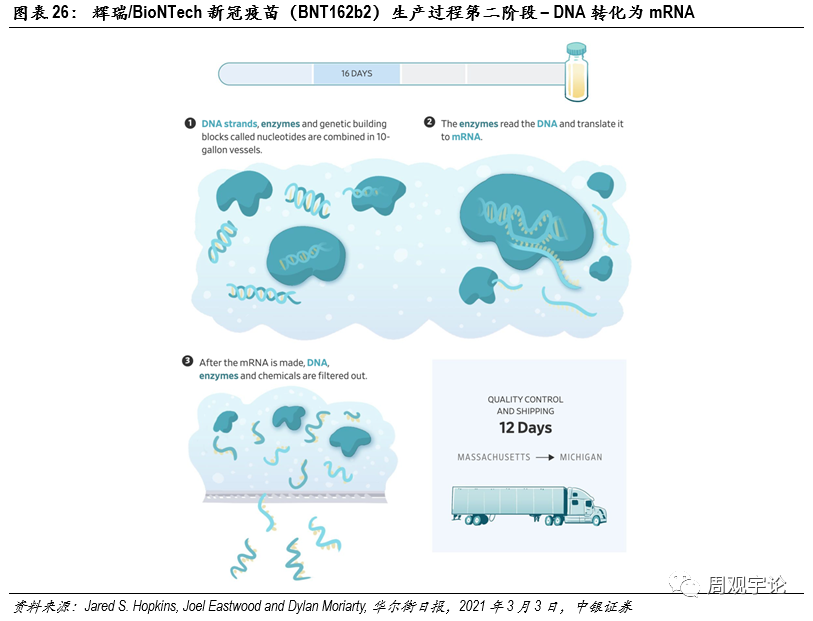
圖表26:輝瑞/BioNTech新(xīn)冠疫苗(BNT162b2)生産(chǎn)過程第二階段 – DNA轉化為(wèi)mRNA
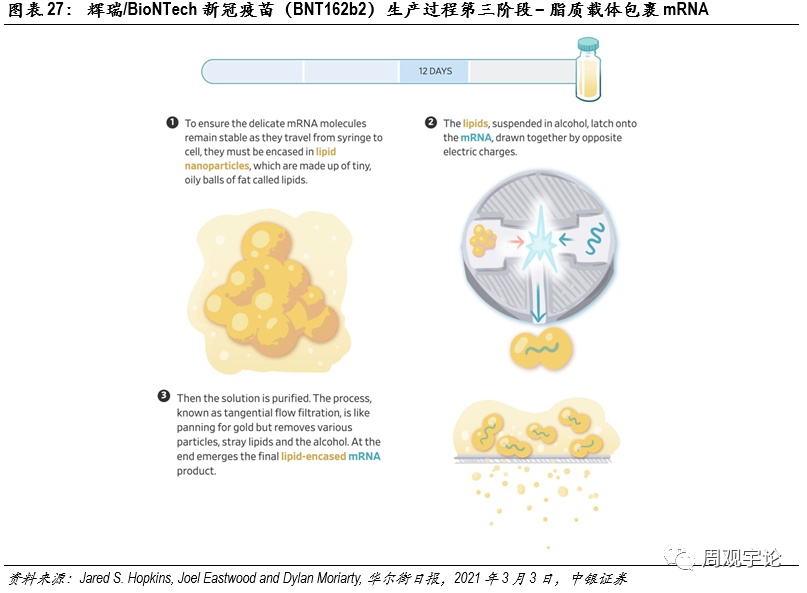
圖表27:輝瑞/BioNTech新(xīn)冠疫苗(BNT162b2)生産(chǎn)過程第三階段 – 脂質(zhì)載體(tǐ)包裹mRNA
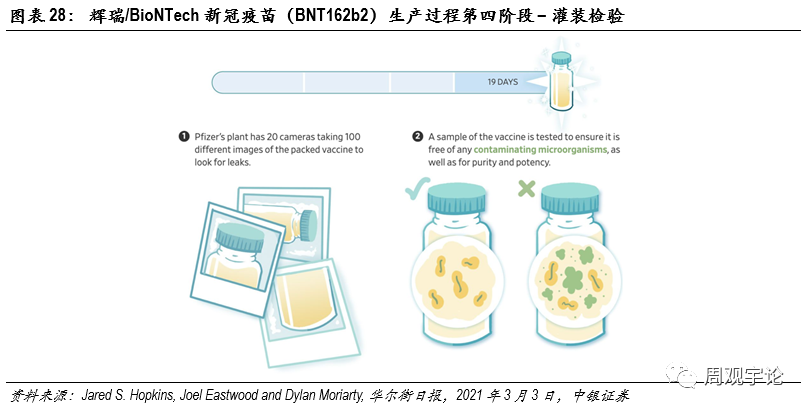
圖表28:輝瑞/BioNTech新(xīn)冠疫苗(BNT162b2)生産(chǎn)過程第四階段 – 灌裝(zhuāng)檢驗
圖表29:密碼子組合與轉譯後所得氨基酸對照表
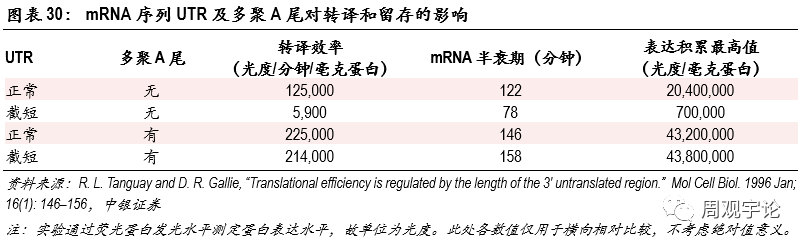
圖表30:mRNA序列UTR及多(duō)聚A尾對轉譯和留存的影響
圖表31:mRNA序列各部分(fēn)對疫苗有(yǒu)效性和安(ān)全性影響
圖表32:LNP專利關系圖表33:Moderna提交對Arbutus三項專利的IPR
圖表34:Moderna在研管線(xiàn)一覽
圖表35:BioNTech已進入臨床階段的在研管線(xiàn)
圖表36:CureVac自有(yǒu)的GMP工(gōng)廠
圖表37:CureVac在研管線(xiàn)一覽
圖表38:各廠商(shāng)mRNA新(xīn)冠疫苗的儲藏條件對比
圖表39:國(guó)産(chǎn)mRNA疫苗企業
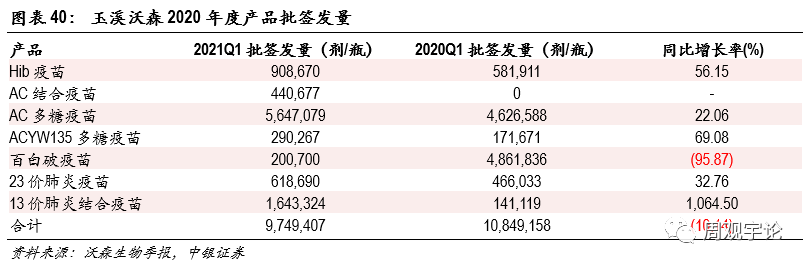
圖表40:玉溪沃森2020年度産(chǎn)品批簽發量
圖表41:2021Q1沃森生物(wù)研發管線(xiàn)
圖表42:複星醫(yī)藥2020年制藥闆塊研發管線(xiàn)統計
前言
mRNA疫苗:疫苗行業新(xīn)王朝的崛起2020年初,一場突如起來的傳染病大流行給全世界帶來了巨大變數。擁有(yǒu)與18年前“非典”罪魁禍首SARS病毒相似的部分(fēn)結構,新(xīn)型冠狀病毒(SARS-CoV-2)甚至擁有(yǒu)了更強大的傳染能(néng)力和應對溫度變化的能(néng)力。全球每月新(xīn)增病例數一路走高,春夏秋冬的自然變化對病毒幾乎無影響。在此情況下,人類把終結這一疫情大流行的唯一希望寄托在疫苗的出世。各國(guó)醫(yī)療機構、企業紛紛投入這一領域中(zhōng)。新(xīn)冠疫苗研發既讓企業履行了社會責任,同時也給予企業巨大的市場空間。全球總人口超過77億,建立起全球性的免疫屏障需要百億劑以上的新(xīn)冠疫苗。在此雙重激勵下,全球湧現出許多(duō)優秀的疫苗企業,以中(zhōng)美德(dé)三國(guó)為(wèi)領導者,在1年内用(yòng)前所未有(yǒu)的速度研制出相應的新(xīn)冠疫苗,讓深陷疫情泥潭的世界看到了曙光。而這些優秀的疫苗中(zhōng),剛剛登上舞台便最為(wèi)閃耀的一個品種是mRNA疫苗。mRNA疫苗打破了傳統滅活、減毒疫苗的免疫激活模式,創新(xīn)性地利用(yòng)人體(tǐ)本身細胞生産(chǎn)抗原,以此激活特異免疫。mRNA疫苗具(jù)有(yǒu)極高的有(yǒu)效保護率,同時相較于其他(tā)創新(xīn)型疫苗(如:DNA疫苗、病毒載體(tǐ)疫苗)具(jù)有(yǒu)更高的安(ān)全性。在研發上,mRNA疫苗能(néng)夠快速地更新(xīn)叠代以應對不斷出現的變異毒株。由于mRNA疫苗不需進行體(tǐ)外轉譯,因此生産(chǎn)過程也有(yǒu)所縮短,僅需要60-70天。美國(guó)疫情的好轉印證了mRNA疫苗的有(yǒu)效性。自美國(guó)總統拜登簽署“百日疫苗接種計劃”後,美國(guó)每日新(xīn)增病例顯著下降。國(guó)内第一輪疫苗接種已接近尾聲,短期内疫苗需求落至低點,但海外疫情持續蔓延,市場機會可(kě)觀。長(cháng)期來看,随着滅活疫苗有(yǒu)效期臨近以及病毒變異加速,在2021年底2022年初國(guó)内可(kě)能(néng)會出現第二輪疫苗需求的高峰。mRNA的應用(yòng)前景非常廣闊。除了能(néng)夠用(yòng)于預防傳染性疾病,mRNA疫苗也為(wèi)治療腫瘤、免疫疾病帶來了新(xīn)的星火。在新(xīn)冠疫情前,國(guó)際mRNA廠商(shāng)的研究重點集中(zhōng)在腫瘤的治療上。目前國(guó)際mRNA疫苗三巨頭為(wèi):BioNTech、CureVac、Moderna,均布局了多(duō)條針對腫瘤的管線(xiàn)。除傳染病和腫瘤免疫疾病外,mRNA疫苗在許多(duō)基因相關的疾病中(zhōng)都有(yǒu)開發潛能(néng)。在後新(xīn)冠疫情時代,mRNA疫苗仍舊具(jù)備大幅增長(cháng)的潛力。mRNA疫苗的技(jì )術壁壘在于序列設計和遞送系統。序列設計需要公(gōng)司擁有(yǒu)大量長(cháng)期的數據積累,不斷訓練優化平台。優秀的序列設計能(néng)夠提高mRNA在體(tǐ)内的留存和作(zuò)用(yòng)時間,降低免疫原性,使mRNA序列更高效地表達抗原蛋白。遞送系統則是mRNA的運載火箭,負責将mRNA成分(fēn)完整地運送至目标靶點,并且在合适的時機和環境條件下及時釋放。同時,遞送載體(tǐ)需要經過人體(tǐ)免疫系統的層層保護,容易引起過敏等免疫反應,傷害疫苗的安(ān)全性。遞送系統還很(hěn)大程度決定了mRNA疫苗的儲藏條件和儲藏時限。目前擁有(yǒu)此技(jì )術的公(gōng)司非常稀少,同時具(jù)有(yǒu)專利保護壁壘,是mRNA疫苗行業“卡脖子”的技(jì )術之一。艾博生物(wù)、斯微生物(wù)是國(guó)産(chǎn)mRNA疫苗進展最快的兩家企業,除此之外,複星醫(yī)藥獲得了BioNTech新(xīn)冠疫苗大中(zhōng)華區(qū)的代理(lǐ),mRNA新(xīn)冠疫苗能(néng)否為(wèi)公(gōng)司創造盈利值得持續關注。
免疫系統及疫苗工(gōng)作(zuò)原理(lǐ)
免疫系統概覽人體(tǐ)免疫系統是一個以功能(néng)作(zuò)為(wèi)定義的系統,而非由器官作(zuò)為(wèi)定義的系統。其中(zhōng)包含皮膚、黏膜等物(wù)理(lǐ)屏障,肝髒等器官分(fēn)泌的蛋白化學(xué)物(wù)質(zhì),也包括巨噬細胞、T細胞等生物(wù)類保護分(fēn)子。免疫系統可(kě)分(fēn)為(wèi)固有(yǒu)性和獲得性免疫。固有(yǒu)性免疫是人體(tǐ)天生帶有(yǒu)的免疫系統,具(jù)有(yǒu)非特異性、反應快速等特點。獲得性免疫則具(jù)有(yǒu)特異性,在首次感染時反應較慢。一般情況下,抵禦外源性入侵物(wù)質(zhì)的第一道防線(xiàn)是固有(yǒu)性免疫。固有(yǒu)免疫中(zhōng)又(yòu)可(kě)分(fēn)為(wèi)外部防禦和内部防禦。外部防禦的典型是皮膚以及黏膜,是人體(tǐ)整套防禦系統的排頭兵。若外部防禦被突破,内部防禦将築起第二道防線(xiàn),其中(zhōng)包括吞噬細胞、抗微生物(wù)蛋白質(zhì)、自然殺手細胞(NKcell)等。若固有(yǒu)免疫無法成功防禦入侵,獲得性免疫則會啓動。由于獲得性免疫具(jù)有(yǒu)特異性,因此針對特定入侵物(wù)質(zhì)的防禦效果較為(wèi)明顯。常見的獲得性免疫可(kě)分(fēn)為(wèi)體(tǐ)液免疫和細胞免疫。目前,幾乎所有(yǒu)疫苗的最終目的都是激活此處所提到的獲得性免疫。
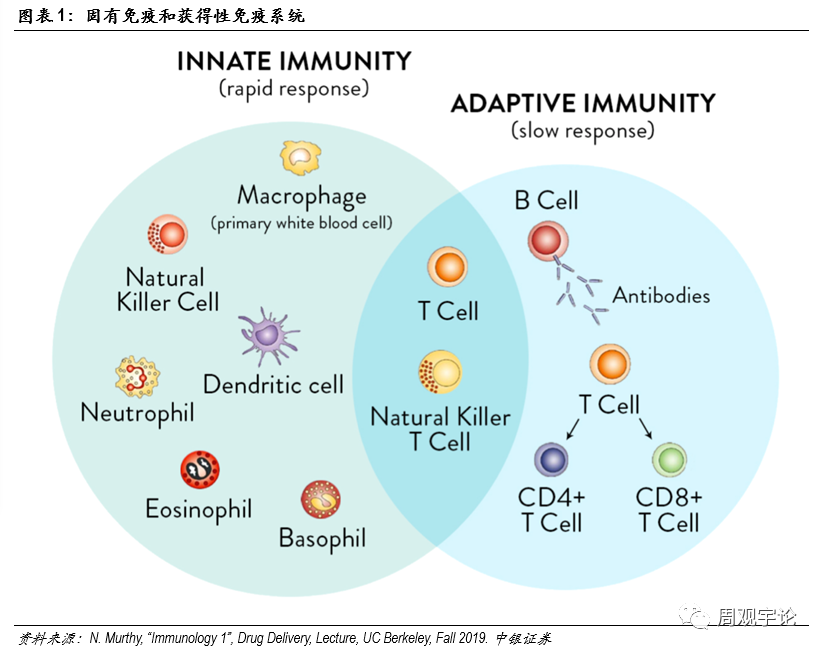 獲得性免疫作(zuò)用(yòng)原理(lǐ)
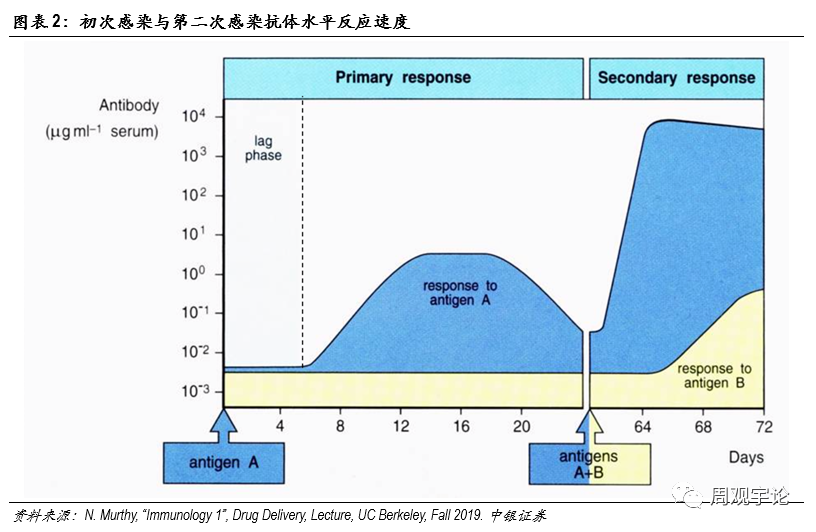
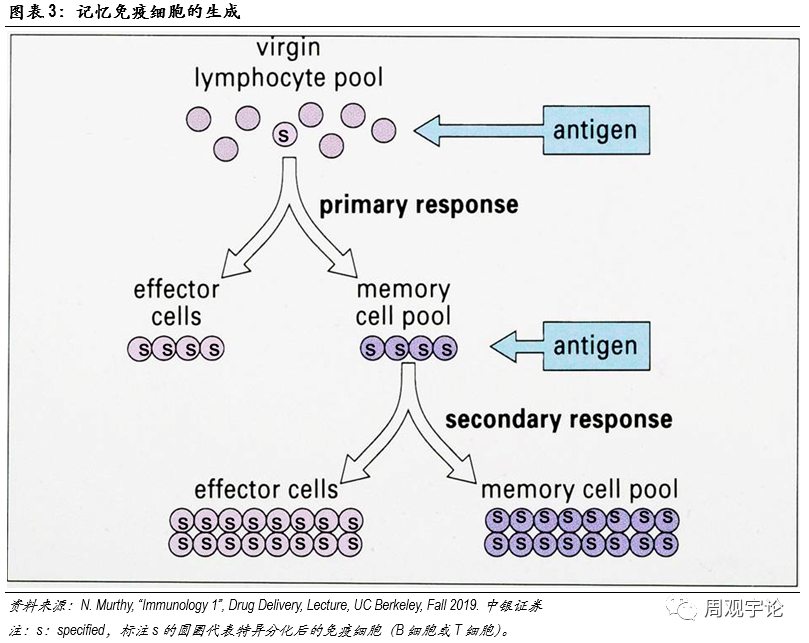
獲得性免疫作(zuò)用(yòng)原理(lǐ)如其名(míng),獲得性免疫指後天得到的免疫。具(jù)體(tǐ)可(kě)分(fēn)為(wèi)體(tǐ)液免疫和細胞免疫。體(tǐ)液免疫的核心細胞是B細胞(B cell)。原始B細胞在接觸到外源性抗原後便被激活,并根據抗原成長(cháng)分(fēn)化為(wèi)特異性B細胞,開始分(fēn)泌特異性抗體(tǐ)。抗體(tǐ)能(néng)夠識别入侵病原體(tǐ)表面的抗原,并與其結合。抗體(tǐ)本身沒有(yǒu)殺死病原體(tǐ)的物(wù)質(zhì),但它能(néng)夠與病原體(tǐ)結合使其失去感染其他(tā)細胞的能(néng)力,同時引導其他(tā)免疫細胞,例如巨噬細胞,将病原體(tǐ)吞噬,一些抗體(tǐ)能(néng)加速病原體(tǐ)細胞的分(fēn)解。根據克隆選擇理(lǐ)論(thecolonal selection theory),病原體(tǐ)被殺滅後,特異化B細胞會繼續留在體(tǐ)内,成為(wèi)免疫系統的一段“記憶”。若再次遇到相同抗原時,留存的B細胞便能(néng)快速擴增、分(fēn)泌抗體(tǐ),而不需重新(xīn)從原始B細胞開始分(fēn)化。因此,首次感染時,B細胞特異免疫反應較慢;而後二次感染時,B細胞特異免疫反應速度則非常迅速。同時,由于特異性B細胞會留存于體(tǐ)内,抗原出現頻率越頻繁,針對此抗原的特異性B細胞擴增數量越多(duō),因此,特異免疫的反應也會越來越快越來越強。這是許多(duō)疫苗需要多(duō)劑次加強的原因。
細胞主導免疫的核心細胞是T細胞(T cell)。T細胞分(fēn)為(wèi)2類:輔助T細胞(CD4+)和殺手T細胞(CD8+)。當外源性蛋白質(zhì)進入體(tǐ)内,部分(fēn)蛋白會被抗原呈遞細胞(Antigen Presenbting Cell,APC)捕捉。常見的APC包括樹突細胞(DendriticCell,DC)、B細胞等。APC通過TLR(Toll-Like Receptor)分(fēn)辨是否是外來抗原。若識别結果為(wèi)外來抗原,APC會将抗原片段以抗原-MHC結合體(tǐ)的形式暴露在APC細胞膜表面。當輔助T細胞的受體(tǐ)(TCR)與MHC-抗原結合時,輔助T細胞會開始複制并釋放細胞素,激活B細胞和殺手T細胞。殺手T細胞被激活後通過MHC結構與APC結合,并釋放穿孔素和顆粒酶。穿孔素會附着在目标細胞膜上形成穿孔,顆粒酶通過穿孔進入細胞内部溶解細胞。當病原體(tǐ)消滅後,部分(fēn)CD4+和CD8+T細胞會繼續留在體(tǐ)内,稱為(wèi)記憶T細胞。與記憶B細胞類似,記憶T細胞擁有(yǒu)對抗原的特異性。若未來遭遇相同的外來抗原,T細胞能(néng)夠迅速擴增激活,殺滅入侵的病原體(tǐ)。總體(tǐ)而言,獲得性免疫的激發來源于對抗原的識别。當某一病原體(tǐ)首次入侵時時,由于沒有(yǒu)現成的特異化B細胞和T細胞,獲得性免疫的應答(dá)時間較長(cháng)。原始B細胞和T細胞需要時間分(fēn)化形成特異性免疫細胞。在完成首次殺滅後,部分(fēn)特異化的B細胞和T細胞會留存于體(tǐ)内成為(wèi)記憶B細胞、記憶T細胞。若未來再次遭遇相同抗原入侵,無需原始B/T細胞重新(xīn)分(fēn)化,記憶B細胞和T細胞将自我擴增、激活,迅速啓動免疫應答(dá)。
 疫苗一般性原理(lǐ)
疫苗一般性原理(lǐ)疫苗的目的是讓人體(tǐ)形成特異性的記憶B細胞和記憶T細胞。在免疫記憶形成後,若人體(tǐ)遭到此病原體(tǐ)襲擊,獲得性免疫能(néng)夠迅速應答(dá),在病原體(tǐ)大規模感染其他(tā)細胞前,将病原體(tǐ)和已被感染的細胞殺滅。目前,絕大部分(fēn)疫苗的邏輯是通過遞送抗原,使人體(tǐ)自發形成特異性免疫反應。相較于直接注射抗體(tǐ)或特異性T細胞,人體(tǐ)自發形成的免疫具(jù)有(yǒu)更好的持續性,同時免疫原性更低。直接注射的外源性抗體(tǐ)或T細胞本質(zhì)上也屬于外來物(wù)質(zhì),在人體(tǐ)内容易遭受免疫系統攻擊。同時,抗體(tǐ)和T細胞本身具(jù)有(yǒu)半衰期,免疫有(yǒu)效時間短。由于直接注射的抗體(tǐ)或T細胞無法成為(wèi)人體(tǐ)免疫記憶的一部分(fēn),因此,人體(tǐ)不能(néng)直接複制注射進入的抗體(tǐ)或T細胞,所以無法在遭遇抗原時快速擴增,免疫反應較弱。直接遞送抗體(tǐ)或T細胞的做法不适用(yòng)于預防領域,但在部分(fēn)治療領域能(néng)夠發揮作(zuò)用(yòng)。目前關注度較高的抗體(tǐ)藥便是将人為(wèi)制造或編輯的抗體(tǐ)導入人體(tǐ)内,直接由注入的抗體(tǐ)對特定細胞進行殺傷或抑制。CAR-T療法則是直接遞送經過人為(wèi)編輯的T細胞(稱為(wèi)CAR-T細胞)進入體(tǐ)内,由這部分(fēn)改裝(zhuāng)過的CAR-T細胞直接殺傷目标細胞(例如腫瘤細胞)。疫苗通過遞送抗原激發人體(tǐ)特異性免疫反應。但與自然界中(zhōng)病原體(tǐ)入侵形成免疫記憶不同,疫苗往往隻遞送無毒無害的某一抗原片段進入人體(tǐ)。抗原本身是無害的,可(kě)視作(zuò)一種标識,供免疫細胞進行識别。因此,疫苗本身并不帶有(yǒu)毒性。
mRNA疫苗mRNA疫苗是一種核酸疫苗,通過将病毒的部分(fēn)mRNA片段注入人體(tǐ)細胞内産(chǎn)生抗原,再由此激發特異性免疫反應,達到形成免疫記憶的效果。
DNA是存儲人體(tǐ)遺傳信息的載體(tǐ)。人體(tǐ)内絕大部分(fēn)細胞都帶有(yǒu)DNA。但是DNA本身無法直接對人體(tǐ)産(chǎn)生影響,各類蛋白質(zhì)才是能(néng)夠左右表象的物(wù)質(zhì)(例如:抗原、激素)。DNA需要轉化為(wèi)蛋白質(zhì)才能(néng)夠将遺傳信息表達出來。整個DNA轉化為(wèi)蛋白質(zhì)的過程分(fēn)為(wèi)兩大步,第一步:DNA轉化為(wèi)mRNA,這一步驟稱為(wèi)轉錄(transcription),發生在細胞核内;第二步:mRNA轉化為(wèi)蛋白質(zhì),這一步驟稱為(wèi)轉譯(translation),發生在細胞質(zhì)中(zhōng)。可(kě)以看到,mRNA是DNA轉化為(wèi)蛋白質(zhì)的中(zhōng)間體(tǐ),這也是它名(míng)稱的由來,即信使RNA(messenger RNA)。通俗來講,DNA類似于底稿,DNA發生的改變會一直存在于體(tǐ)内,由此細胞分(fēn)裂新(xīn)産(chǎn)生的細胞也會繼承這些改變,因此DNA的改變有(yǒu)很(hěn)大概率會伴随一生,其中(zhōng)性細胞中(zhōng)DNA的變化甚至能(néng)夠遺傳至下一代。mRNA類似于說明書,能(néng)夠指導自身細胞生産(chǎn)出特定的蛋白,但是mRNA的改變不會被分(fēn)裂産(chǎn)生的新(xīn)細胞繼承,也不會遺傳至下一代個體(tǐ)中(zhōng)。蛋白則是最終生産(chǎn)得到的工(gōng)具(jù),對生物(wù)個體(tǐ)的各項指标直接産(chǎn)生作(zuò)用(yòng)。同樣地,蛋白不會被繼承或遺傳。這一條轉錄轉譯鏈被稱為(wèi)生物(wù)學(xué)“中(zhōng)心法則”。mRNA疫苗利用(yòng)了兩步表達的機理(lǐ),使疫苗在不改變DNA序列的同時,為(wèi)人體(tǐ)免疫系統的激活提供更準确的抗原蛋白以及更持久的抗原體(tǐ)内留存時間,使被激活的特異性免疫更精(jīng)準,同時免疫效果得到鞏固。具(jù)體(tǐ)來分(fēn)析mRNA新(xīn)冠疫苗的機理(lǐ)。mRNA疫苗中(zhōng)的mRNA片段編碼新(xīn)冠病毒表面的某些蛋白或受體(tǐ),例如刺突蛋白(S蛋白)。疫苗遞送人工(gōng)編輯後的mRNA進入人體(tǐ)細胞,在體(tǐ)内“借用(yòng)”人體(tǐ)自身細胞轉譯mRNA為(wèi)蛋白質(zhì)。此類mRNA在經過轉譯後會表達成為(wèi)病毒所具(jù)有(yǒu)的某種抗原蛋白。雖然産(chǎn)生的抗原是由自身細胞制造,但由于其氨基酸序列具(jù)有(yǒu)外源性,APC中(zhōng)的TLR并不識别此段序列,因此仍舊會激發B細胞和T細胞針對此抗原蛋白的特異性免疫反應,并建立免疫記憶。
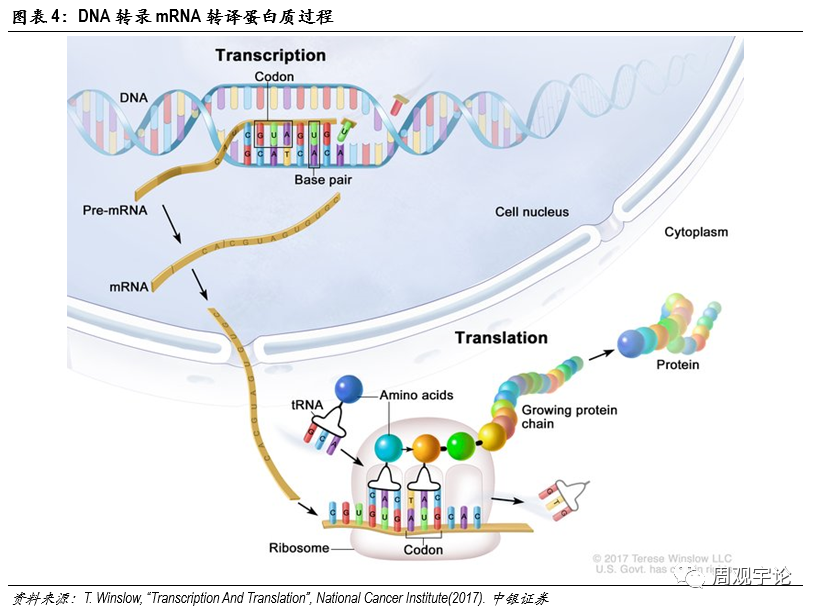
如今,病毒遺傳信息序列的解碼和反向序列合成已不是難題。如何将合成好的mRNA序列遞送進入人體(tǐ)細胞變成了mRNA疫苗研發的重要挑戰之一。人體(tǐ)細胞結構從外至内可(kě)分(fēn)為(wèi)細胞膜(cellmembrane)、細胞質(zhì)(cytoplasm)、細胞核(nucleus)。mRNA轉譯成蛋白質(zhì)的過程發生在細胞質(zhì)中(zhōng),因此,mRNA疫苗要發揮作(zuò)用(yòng),必須先将編輯好的mRNA轉遞進細胞質(zhì)中(zhōng)。進入細胞質(zhì)需要通過細胞膜,細胞膜由磷脂雙分(fēn)子層構成,磷脂分(fēn)子頭部具(jù)有(yǒu)親水性,尾部具(jù)有(yǒu)疏水性,兩層磷脂尾部相對形成雙分(fēn)子層,能(néng)夠有(yǒu)效控制水分(fēn)子、離子、大分(fēn)子物(wù)質(zhì)通過。mRNA作(zuò)為(wèi)大分(fēn)子(300-5000kDa),在不破壞細胞膜的前提下,進出細胞隻能(néng)以内含體(tǐ)(endosome)通過胞吞作(zuò)用(yòng)(endocytosis)。通常情況下,内含體(tǐ)進入細胞質(zhì)後,會被直接送至溶酶體(tǐ)(lysosome)進行分(fēn)解。為(wèi)保證mRNA在轉譯前保持完整性,mRNA需要在内含體(tǐ)與溶酶體(tǐ)結合前打破内含體(tǐ)包膜(endosomaldisruption)并逃離。逃離内含體(tǐ)進入細胞質(zhì)後,mRNA便會在細胞質(zhì)内遊動,直至到達核糖體(tǐ)(ribosome)并在
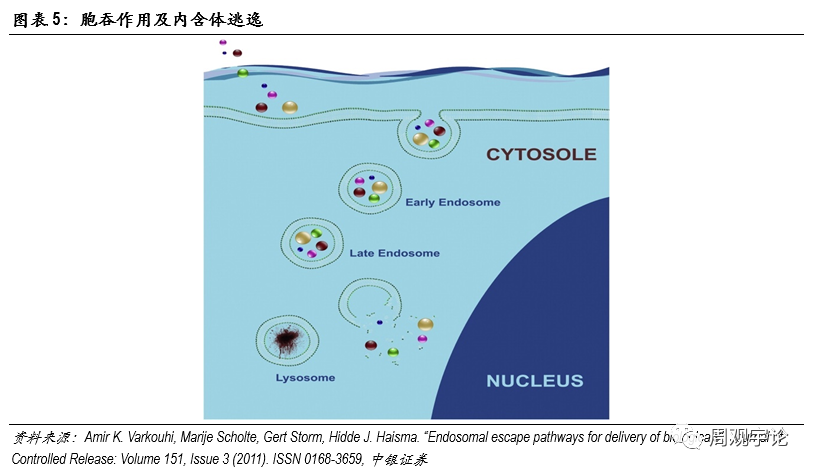
此轉譯為(wèi)肽鏈,最終折疊成為(wèi)蛋白質(zhì)。對于mRNA疫苗和藥物(wù),遞送系統有(yǒu)兩大職責:一是有(yǒu)效包裹和保護mRNA在到達靶點前維持穩定,二是幫助mRNA有(yǒu)效成分(fēn)進入細胞,三是在mRNA到達溶酶體(tǐ)前将其釋放進入細胞質(zhì)中(zhōng)。LNP是目前最具(jù)潛力的遞送載體(tǐ)之一。LNP(Lipid Nanoparticle)是脂質(zhì)微粒的總稱,其中(zhōng)又(yòu)包括脂質(zhì)膠團(micelle)、脂質(zhì)體(tǐ)(liposome)等。LNP與細胞膜的組成成分(fēn)相似,均由脂質(zhì)分(fēn)子構成。脂質(zhì)分(fēn)子的兩條長(cháng)尾通常呈平行狀态,在此狀态下,脂質(zhì)形成的雙分(fēn)子層穩定。在進入細胞質(zhì)酸性環境後,部分(fēn)脂質(zhì)的頭部質(zhì)子化,呈現陽離子形态,與其他(tā)陰性離子态的脂質(zhì)分(fēn)子相吸引,尾部張開。原本雙分(fēn)子層的形式被破壞,形成頭部聚集在一起的環狀。之前包裹在内的mRNA便可(kě)逃逸出内含體(tǐ),進入細胞質(zhì)等待轉譯。
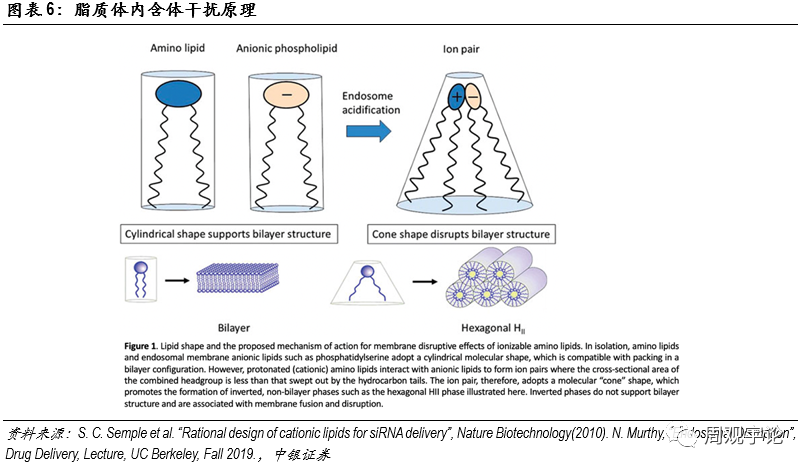
為(wèi)了提高載體(tǐ)對包裹成分(fēn)的保護能(néng)力,通過在載體(tǐ)外部連接PEG可(kě)以進一步增強載體(tǐ)的穩定性。
mRNA疫苗相較于其他(tā)技(jì )術路徑疫苗的優劣勢分(fēn)析
(1)mRNA疫苗 vs. 滅活疫苗:具(jù)有(yǒu)明顯的免疫保護力優勢與傳統滅活疫苗、裂解疫苗相比,mRNA疫苗激活特異免疫的路徑不相同。傳統疫苗激活特異性免疫的方式是直接将抗原蛋白注射進入人體(tǐ),引起免疫反應;而mRNA是将編碼病毒抗原的mRNA注入體(tǐ)内,由人體(tǐ)自身細胞産(chǎn)生對應的抗原,以此激活特異性免疫。理(lǐ)論分(fēn)析,mRNA疫苗能(néng)夠呈現更多(duō)的抗原,同時能(néng)更持久地激活鞏固特異性免疫。原因在于,傳統滅活疫苗的抗原呈遞數量是一定的,即最終到達體(tǐ)内引起免疫反應的抗原數量隻能(néng)夠小(xiǎo)于或等于疫苗中(zhōng)含有(yǒu)的抗原數量。同時,滅活疫苗呈遞抗原的過程是一次性的,注射時疫苗呈遞的抗原即為(wèi)所有(yǒu)抗原,這些抗原的降解時長(cháng)即為(wèi)持續激活免疫的時長(cháng),此後不會有(yǒu)新(xīn)增抗原。而mRNA疫苗抗原呈遞的過程是可(kě)短暫持續的,呈遞的mRNA可(kě)指導多(duō)個核糖體(tǐ)産(chǎn)生抗原蛋白,直至mRNA 降解。由于細胞能(néng)夠不斷根據mRNA生産(chǎn)抗原蛋白,因此抗原數量受疫苗劑量所限制較小(xiǎo),從時間維度上看,抗原不會在短時間内迅速被消耗完畢。抗原數量水平越高、保持時長(cháng)越長(cháng),形成的特異性免疫記憶越強烈,免疫應答(dá)更快、持續時間越長(cháng)。
(2)mRNA疫苗 vs. DNA疫苗:更高效,逆轉錄風險較小(xiǎo)與核酸疫苗中(zhōng)另一路徑的DNA疫苗相比,mRNA疫苗更有(yǒu)效也更安(ān)全。DNA疫苗需要将包裹的有(yǒu)效成分(fēn)遞送通過兩層屏障:細胞膜和細胞核膜,最終進入細胞核内開始抗原蛋白的表達。多(duō)層屏障導緻有(yǒu)效成分(fēn)難以進入反應場所,免疫激活更難。同時,由于DNA疫苗呈遞的有(yǒu)效成分(fēn)需要進入細胞核内,導緻外源遺傳片段逆轉錄進入人體(tǐ)DNA的概率增加,引起腫瘤癌症的概率增加。相較而言,由于mRNA疫苗導入的外源物(wù)質(zhì)不需進入細胞核,發生外源遺傳片段逆轉錄進入人體(tǐ)自身DNA的概率較小(xiǎo),因此引起腫瘤癌症的概率極小(xiǎo)。
(3)mRNA疫苗 vs. 病毒載體(tǐ)疫苗:适用(yòng)人群覆蓋全面,逆轉錄風險較小(xiǎo),機會成本更低LNP為(wèi)遞送mRNA片段到達靶點、定點釋放提供了支持。另一大受到較高關注度的載體(tǐ)平台是病毒載體(tǐ)平台,常見的類别有(yǒu)腺病毒(Adenovirus)、腺相關病毒(Adeno-Associated Virus,AAV)、慢病毒(lentivirus)。病毒載體(tǐ)通過去除病毒本身的有(yǒu)害物(wù)質(zhì),保留感染能(néng)力,将目标物(wù)質(zhì)遞送進入細胞内,由細胞産(chǎn)生抗原蛋白,進而引起特異性免疫反應。病毒載體(tǐ)反應的一大缺陷是,若接種者本身體(tǐ)内含有(yǒu)針對此病毒載體(tǐ)的抗體(tǐ)(如腺病毒、AAV、慢病毒,而非針對目标抗原的抗體(tǐ)),或在短時間内快速産(chǎn)生了抗體(tǐ),則病毒載體(tǐ)疫苗無法将有(yǒu)效成分(fēn)遞送進入預定的細胞質(zhì)内。相比之下,LNP的結構由脂質(zhì)分(fēn)子構成,載體(tǐ)引起免疫反應的幾率較小(xiǎo),能(néng)夠更有(yǒu)效地遞送有(yǒu)效成分(fēn)至目标靶點。除此之外,部分(fēn)病毒平台有(yǒu)發生逆轉錄的概率,會将外源基因整合進入人體(tǐ)DNA中(zhōng),可(kě)能(néng)導緻腫瘤、免疫疾病等。同時,病毒載體(tǐ)疫苗具(jù)有(yǒu)更高的機會成本。當人體(tǐ)接受病毒載體(tǐ)疫苗注射後,體(tǐ)内會自動産(chǎn)生針對此載體(tǐ)的抗體(tǐ)和其他(tā)特異免疫反應。此後再次運用(yòng)相同或相似病毒載體(tǐ)作(zuò)為(wèi)遞送系統給藥時(例如一些腫瘤治療藥物(wù)),會更容易遭到免疫系統的攻擊,難以成功将藥物(wù)遞送至靶點。
mRNA新(xīn)冠疫苗臨床數據解析:No pain, no gain
mRNA疫苗的臨床運用(yòng)曆史始于2020年新(xīn)冠疫情。根據WHO數據,截止2021年5月7日,全球共有(yǒu)15款mRNA疫苗在研,其中(zhōng)包括已納入WHO緊急使用(yòng)名(míng)單(Emergency Use Listing,EUL)的2款mRNA疫苗:由輝瑞/BioNTech聯合研發的BNT162b2,以及由Moderna研發的mRNA-1273。
mRNA疫苗展現了令人振奮的保護率
2020年11月18日,輝瑞發布了BNT162b2的III期臨床試驗結果,結果顯示疫苗整體(tǐ)保護率高達95%。2021年3月31日,Moderna發布了mRNA-1273的III期臨床試驗結果,結果顯示疫苗整體(tǐ)保護率也達到94.1%,與BNT162b2的數據非常接近。2款mRNA疫苗同時展現出極為(wèi)優異的保護率,共同預示着mRNA疫苗技(jì )術在激活免疫系統上的令人震驚的高效,也讓科(kē)學(xué)界對mRNA疫苗技(jì )術未來在其他(tā)疾病領域可(kě)能(néng)帶來的改變充滿期待。同時,mRNA疫苗在65歲及以上的老年群體(tǐ)中(zhōng),仍能(néng)高效地激發免疫反應,保護率穩定在高水平。
(1)輝瑞/BioNTech mRNA疫苗(BNT162b2)有(yǒu)效性臨床試驗數據分(fēn)為(wèi)兩部分(fēn)。第一部分(fēn),樣本人群為(wèi)在實驗前或實驗開始時均未感染新(xīn)冠病毒的人群,本樣本人群共有(yǒu)36523人,其中(zhōng)疫苗組18198人,均接受2劑BNT162b2注射;另外18325人為(wèi)安(ān)慰劑組,接受2劑安(ān)慰劑注射。在完成2劑接種7天後,疫苗組出現8例新(xīn)冠感染者,安(ān)慰劑組出現162例,疫苗有(yǒu)效保護率達到95.0%。第二部分(fēn)樣本人群包括感染和未感染新(xīn)冠病毒的人群。樣本人數40137人,其中(zhōng)疫苗組19965人,安(ān)慰劑組 18325人。在完成2劑接種7天後,疫苗組中(zhōng)出現9例新(xīn)冠感染者,安(ān)慰劑組169例。疫苗有(yǒu)效保護率達到94.6%。
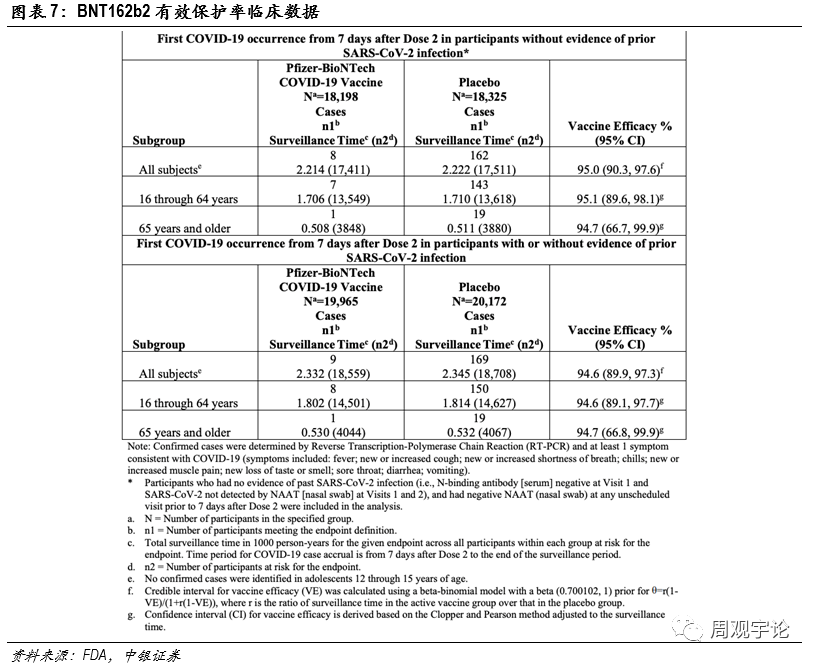
根據年齡段劃分(fēn),BNT162b2對16-64歲人群的保護率為(wèi)95.1%,對65歲及以上的老年群體(tǐ)保護率則維持在了94.7%。數據顯示了mRNA疫苗在人群中(zhōng)激活免疫系統的能(néng)力基本不受接種者年齡的影響。
(2)Moderna mRNA疫苗(mRNA-1273)有(yǒu)效性全球領先上市的另一款mRNA新(xīn)冠疫苗是Moderna公(gōng)司與美國(guó)國(guó)家過敏及傳染疾病研究所(NIAID)研發的mRNA-1273。這款疫苗的技(jì )術路徑與輝瑞/BioNTech的mRNA疫苗相同,臨床結果也展現了令人振奮的保護率,以及較低的不良反應發生概率。根據Moderna公(gōng)司給醫(yī)療服務(wù)機構的事實陳述,mRNA-1273的保護率達到約94.1%(95%CI:89.3%-96.8%)。在針對18歲以上人群的臨床試驗中(zhōng),科(kē)學(xué)家将樣本人群分(fēn)為(wèi)兩組:疫苗組14134人,均接受2劑mRNA-1273注射;另外14073人為(wèi)安(ān)慰劑組,接受安(ān)慰劑注射。在完成第2劑接種14天後,疫苗組中(zhōng)出現新(xīn)冠病例11例,每年每千人病例數為(wèi)3.328;安(ān)慰劑對照組中(zhōng)出現新(xīn)冠病例185例,每年每千人病例數為(wèi)56.510。由此測得,疫苗保護率約為(wèi)94.1%,與輝瑞/BioNTech的mRNA新(xīn)冠疫苗臨床有(yǒu)效率非常相近。Moderna和輝瑞/BioNTech mRNA疫苗的臨床實驗結果都顯示出采用(yòng)mRNA技(jì )術路徑的疫苗具(jù)有(yǒu)極高的有(yǒu)效性。
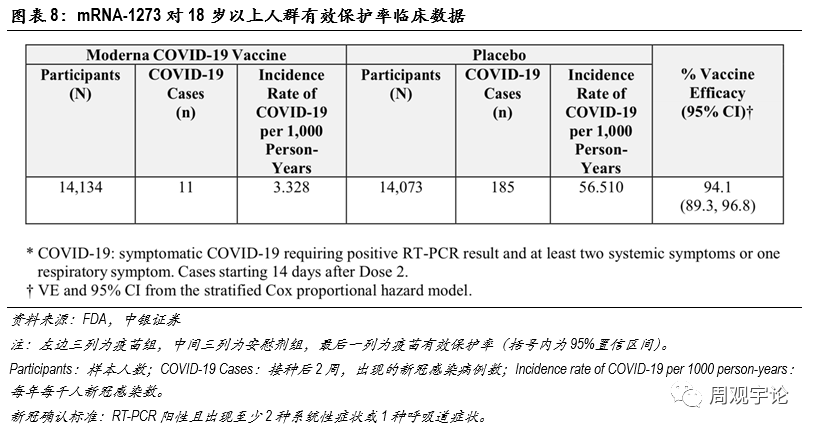
本次臨床試驗的樣本人群中(zhōng)包含了65歲及以上的老年人群,疫苗組中(zhōng)有(yǒu)3583位老年人,其中(zhōng)出現4例新(xīn)冠感染;安(ān)慰劑組中(zhōng)有(yǒu)3552位老年人,其中(zhōng)出現29例新(xīn)冠感染。因此,mRNA-1273對于65歲及以上的人群的有(yǒu)效保護率為(wèi)86.4%,表現仍舊非常優秀。
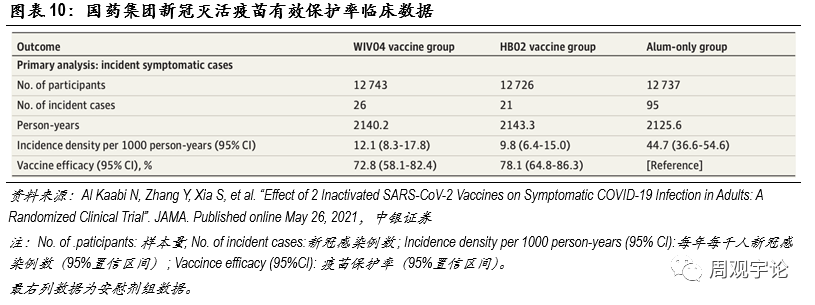
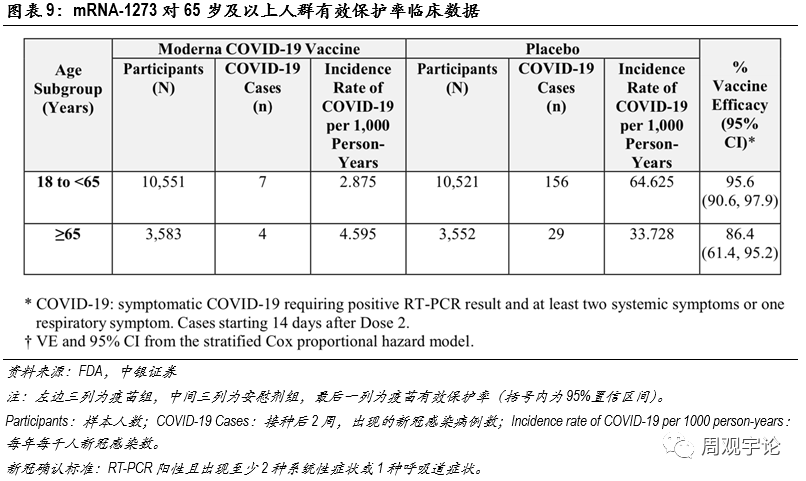 (3)國(guó)藥集團滅活疫苗(WIV04/HB02)有(yǒu)效性
(3)國(guó)藥集團滅活疫苗(WIV04/HB02)有(yǒu)效性為(wèi)了更直觀地展現mRNA疫苗與傳統疫苗在不同指标上的差别,我們在此引用(yòng)使用(yòng)最為(wèi)廣泛的滅活型疫苗進行對比。國(guó)藥集團及北京生物(wù)研究所、武漢生物(wù)研究所共同研發的WIV04和HB02是2款最先上市的傳統滅活疫苗。2021年5月26日,JAMA發布了國(guó)藥集團2款滅活新(xīn)冠疫苗的臨床III期結果。臨床結果展現了不錯的保護率,整體(tǐ)保護率均在70%以上,遠(yuǎn)遠(yuǎn)超出了世界衛生組織50%的要求。具(jù)體(tǐ)數據如下:接種WIV04 的12743人中(zhōng),出現26例新(xīn)冠感染;接種HB02的12726人中(zhōng),出現21例新(xīn)冠感染;安(ān)慰劑組共12737人,出現95例新(xīn)冠感染。由此可(kě)計算得到WIV04的保護率為(wèi)72.8%(95%CI:58.1-82.4),HB02的保護率為(wèi)78.1%(95%CI:64.8-86.3)。2款滅活疫苗整體(tǐ)保護率相近,但是與2款mRNA疫苗>90%的保護率相比,仍舊略遜一籌。
 mRNA疫苗不良反應:短期反應略高于傳統疫苗,需要時間驗證長(cháng)期安(ān)全性
mRNA疫苗不良反應:短期反應略高于傳統疫苗,需要時間驗證長(cháng)期安(ān)全性
除了有(yǒu)效保護率外,疫苗的另一重要指标是不良反應發生的種類和概率。總體(tǐ)來說,滅活疫苗因其成熟的技(jì )術和研發生産(chǎn)經驗,不良反應發生頻率較低,反應程度也較為(wèi)溫和。mRNA疫苗則運用(yòng)了全新(xīn)的技(jì )術,目前得到的安(ān)全數據隻反映了接種後短期内可(kě)能(néng)發生的不良反應,是否會對人體(tǐ)造成長(cháng)期的影響還需要時間進行長(cháng)期的觀察。從理(lǐ)論分(fēn)析,mRNA疫苗通過使部分(fēn)人體(tǐ)細胞表達外源抗原來激活免疫,除了抗原本身會引起免疫反應,這部分(fēn)表達抗原的自體(tǐ)細胞可(kě)能(néng)也會引起較強烈的免疫反應。滅活疫苗則是直接呈遞抗原,因此免疫反應較小(xiǎo)。
(1)輝瑞/BioNTech mRNA疫苗(BNT162b2)安(ān)全性臨床試驗記錄了樣本人群每劑次接種後7天以内的不良反應,并将樣本人群分(fēn)為(wèi)3個年齡階段:12-15歲、18-55歲、56歲及以上,以研究疫苗對青少年和老年人是否安(ān)全。總體(tǐ)來說,第二次接種後絕大多(duō)數各類不良反應出現的概率均高于第一次接種後。局部不良反應中(zhōng),注射處疼痛報告比例較高,第一次、第二次接種後報告疼痛的比例為(wèi)83.1%、77.8%(對應安(ān)慰劑組14.0%、11.7%),其中(zhōng)嚴重疼痛以緻于無法進行日常活動的比例為(wèi)1.0%、1.2%(對應安(ān)慰劑組0.1%、0.0%)。系統性不良反應中(zhōng)報告最多(duō)的是頭痛和疲憊。在18-55歲主要年齡層的研究中(zhōng),第一次接種後頭痛和疲憊的出現幾率分(fēn)别為(wèi)41.9%、47.4%(對應安(ān)慰劑組33.7%、33.4%),第二次接種後的幾率分(fēn)别為(wèi)51.7%、59.4%(對應安(ān)慰劑組24.1%、22.8%)。其他(tā)不良反應中(zhōng),接種第一劑疫苗後,嘔吐、腹瀉出現的概率分(fēn)别為(wèi)1.2%、11.1%,但安(ān)慰劑組的對應概率也分(fēn)别達到1.2%、11.7%,不良反應出現概率與疫苗組持平甚至更高,因此無法判斷此類不良反應的出現是否和疫苗接種有(yǒu)因果關系。相較于第一劑接種,第二劑接種後出現不良反應的概率要更高,出現發熱的頻率達到15.8%(對應安(ān)慰劑組0.5%),發冷、肌肉疼痛和關節疼痛的出現頻率也較高,分(fēn)别為(wèi)35.1%(對應安(ān)慰劑組3.8%)、37.3%(對應安(ān)慰劑組8.2%)、21.9%(對應安(ān)慰劑組5.2%)。
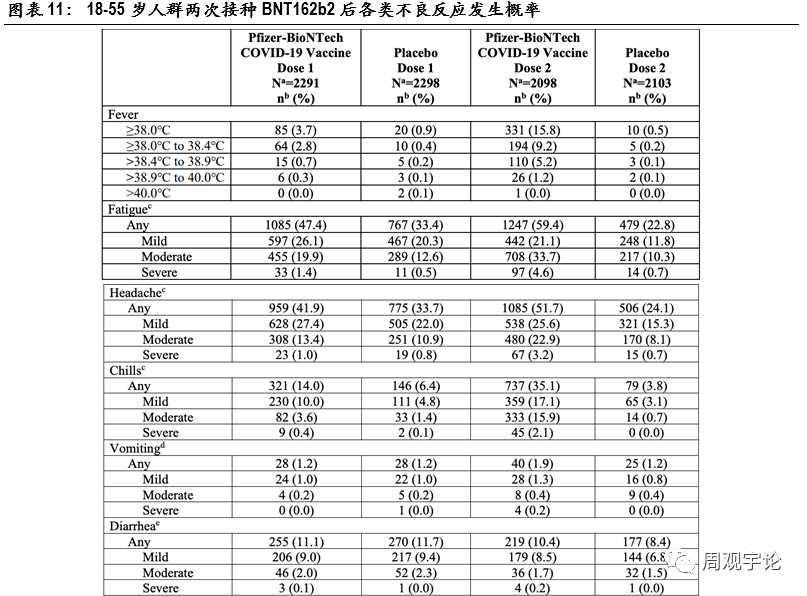
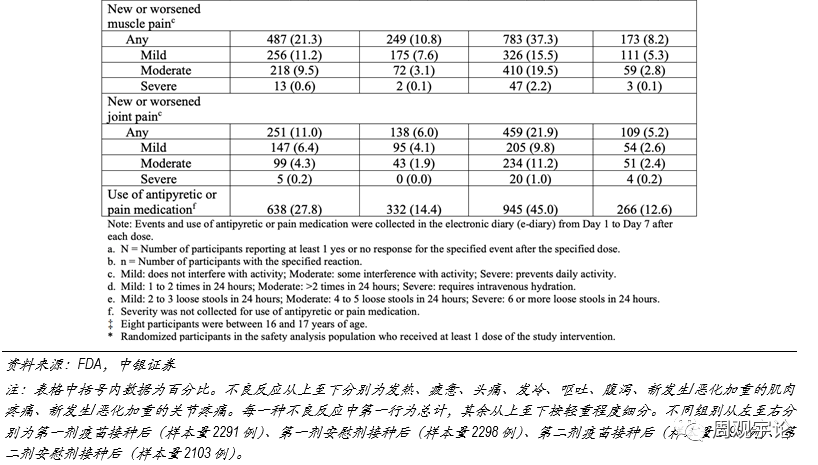
56歲及以上人群接種疫苗後不良反應的發生頻率并未顯示出疫苗會對老年群體(tǐ)造成更嚴重的副作(zuò)用(yòng),老年人群報告的不良反應發生頻率甚至略低于18-55歲年齡段的水平。不同種類的不良反應發生規律與18-55歲年齡層類似,頭疼和疲憊的發生頻率較高。
12-15歲年齡層人群接種疫苗後不良反應的發生規律與其他(tā)兩個年齡層相似,不良反應發生概率略高于其他(tā)兩個年齡層。12-15歲年齡層人群接種疫苗後出現發熱的概率較高。接種第一劑後的發熱概率為(wèi)10.1%(對應安(ān)慰劑組1.1%),接種第二劑後的發熱概率為(wèi)19.6%(對應安(ān)慰劑組0.6%)。
根據CDC數據,截至2021年1月18日,接種BNT162b2疫苗後引起的過敏反應在每百萬人中(zhōng)僅出現5例,概率極低。
(2)Moderna mRNA疫苗(mRNA-1273)安(ān)全性Moderna mRNA-1273的臨床不良反應研究記錄了每劑次接種後7天以内的不良反應,将樣本人群分(fēn)為(wèi)2個年齡階段:18-64歲、65歲及以上,同時每個年齡層中(zhōng)分(fēn)為(wèi)疫苗組和安(ān)慰劑組。總體(tǐ)來說,第二次接種後絕大多(duō)數各類不良反應出現的概率均高于第一次接種後。局部不良反應中(zhōng),疼痛仍舊是占比最高的,第一次和第二次接種後報告疼痛的比例分(fēn)别為(wèi)86.9%、89.9%(對應安(ān)慰劑組19.1%、18.7%)。其中(zhōng)三級疼痛報告比例分(fēn)别為(wèi)3.2%、4.6%(對應安(ān)慰劑組0.2%、0.2%)。系統性不良反應中(zhōng),疲憊報告比例仍舊最高,第一次和第二次接種後報告疲憊的比例分(fēn)别為(wèi)38.4%、67.6%(對應安(ān)慰劑組28.8%、24.6%),與BNT162b2數據相近。不良反應種類中(zhōng),除注射處疼痛外,報告最多(duō)的不良反應是頭痛和疲憊。在18-55歲主要年齡層的研究中(zhōng),第一次接種後頭痛和疲憊的出現幾率分(fēn)别為(wèi)41.9%、47.4%(對應安(ān)慰劑組33.7%、33.4%),第二次接種後的幾率分(fēn)别為(wèi)51.7%、59.4%(對應安(ān)慰劑組24.1%、22.8%)。其他(tā)不良反應中(zhōng),接種第一劑疫苗後,嘔吐、腹瀉出現的概率分(fēn)别為(wèi)1.2%、11.1%,但安(ān)慰劑組的對應概率也分(fēn)别達到1.2%、11.7%,不良反應出現概率與疫苗組持平甚至更高,因此無法判斷此類不良反應的出現是否和疫苗接種有(yǒu)因果關系。相較于第一劑接種,第二劑接種後出現不良反應的概率要更高,出現發熱的頻率達到15.8%(對應安(ān)慰劑組0.5%),發冷、肌肉疼痛和關節疼痛的出現頻率也較高,分(fēn)别為(wèi)35.1%(對應安(ān)慰劑組3.8%)、37.3%(對應安(ān)慰劑組8.2%)、21.9%(對應安(ān)慰劑組5.2%)。
65歲及以上人群接種疫苗後不良反應的發生規律與18-64歲年齡層類似,局部不良反應中(zhōng)疼痛的出現頻率較高,第一次和第二次注射後出現概率分(fēn)别為(wèi)74.0%、83.2%(對應安(ān)慰劑組12.8%、12.0%)。系統性反應中(zhōng),頭疼和疲憊的發生頻率較高。第二劑接種後,發熱、發冷、肌肉關節疼痛等不良反應出現概率較第一劑接種後數據上升較為(wèi)明顯。
2款mRNA疫苗的III期臨床試驗不良反應數據方面接近,局部反應中(zhōng)疼痛最為(wèi)普遍,在主要人群中(zhōng)第一劑次和第二劑次平均出現概率為(wèi)82.4%、85.0%(對應安(ān)慰劑組16.3%、15.6%)。系統性不良反應中(zhōng)疲憊與頭痛出現比例較高,在18歲及以上人群接種第二劑次後,疲憊與頭痛的報告比例分(fēn)别為(wèi),三級及以上疲憊的出現概率平均為(wèi)7.68%(對應安(ān)慰劑組0.67%),三級及以上頭痛的出現概率為(wèi)3.99%(對應安(ān)慰劑組0.99%)。
(3)國(guó)藥集團滅活疫苗(WIV04/HB02)安(ān)全性傳統疫苗例如滅活疫苗相較而言較為(wèi)安(ān)全,不良反應出現頻率低。滅活疫苗采用(yòng)的技(jì )術路徑相對簡易,外源物(wù)質(zhì)不需要進入細胞(mRNA需要進入細胞質(zhì)),因此激發的免疫反應較溫和。從臨床數據來看,滅活疫苗這一技(jì )術路徑已經過長(cháng)期不同種類疫苗的驗證,并未發現長(cháng)期對人體(tǐ)有(yǒu)負面影響。由于統計标準不同,從國(guó)藥集團2款滅活疫苗的III期臨床數據中(zhōng),我們摘取了第一劑接種後0-28天内(期間部分(fēn)樣本人群接種了第二劑疫苗)發生的不良反應報告。發生最普遍的仍舊是疼痛,平均發生頻率為(wèi)21.8%(對應安(ān)慰劑組27.9%),顯著低于mRNA疫苗80%左右(對應安(ān)慰劑組15%左右)的水平,并且疫苗組數據小(xiǎo)于對照組數據。系統性不良反應中(zhōng),報告頻率較高的是疲憊與頭痛,分(fēn)别為(wèi)11.3%、13.4%(對應安(ān)慰劑組10.8%、13.0%),其中(zhōng)三級疲憊與頭痛報告比例分(fēn)别為(wèi)1.1%、1.0%(對應安(ān)慰劑組<0.1%、<0.1%),顯著低于mRNA疫苗數據。
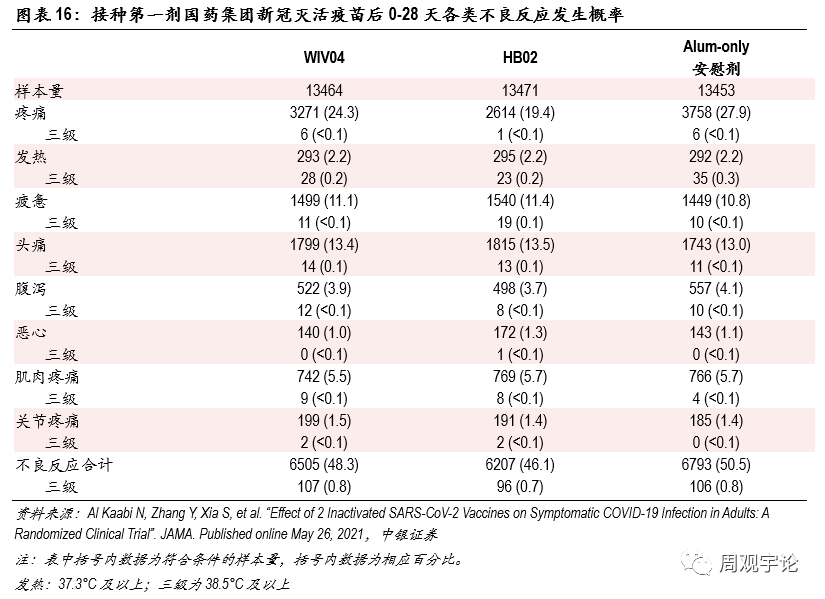
從不良反應發生比例來看,滅活疫苗接種後短期内各項不良反應發生比例明顯低于mRNA疫苗。雖然三款疫苗臨床試驗對于不良反應的定義不同,對照組不同,數據收集周期有(yǒu)差别,但數據上巨大的差異仍能(néng)或多(duō)或少地體(tǐ)現出mRNA疫苗會帶來較多(duō)較強烈的不适。發熱,作(zuò)為(wèi)能(néng)夠進行橫向量化對比的不良反應之一,在接種mRNA疫苗後出現頻率遠(yuǎn)遠(yuǎn)高于接種滅活疫苗後的頻率。接種滅活疫苗後發熱(38.0°C以上)的發生比例平均為(wèi)0.4%,38.5°C以上的發生比例為(wèi)0.2%;接種mRNA疫苗後發熱(38.0°C以上)的平均發生比例為(wèi)17.1%,39°C及以上的平均發生比例為(wèi)1.7%,均高于滅活疫苗的對應數據。
 mRNA疫苗臨床數據特點:No pain,no gain
mRNA疫苗臨床數據特點:No pain,no gain
mRNA疫苗同時具(jù)有(yǒu)高保護率和相對更多(duō)的不良反應。英美俗語“Nopain, no gain” (“沒有(yǒu)痛苦便沒有(yǒu)收獲”),貼切地形容了mRNA疫苗的特點。
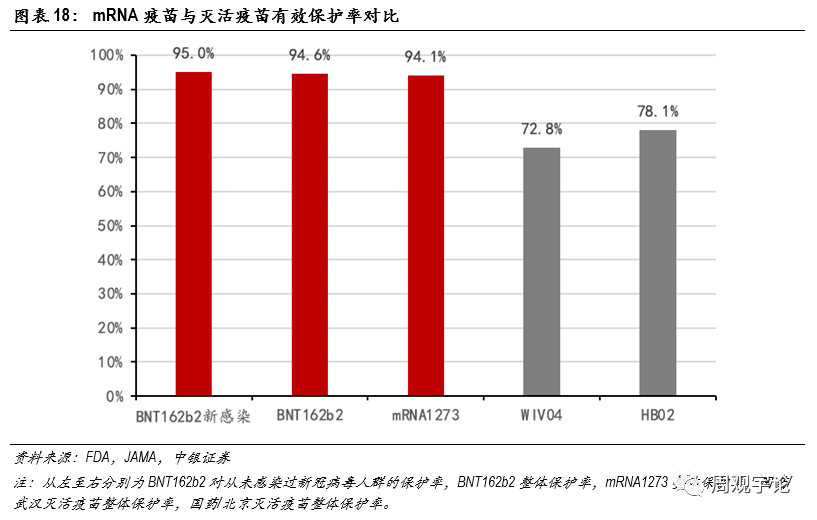
mRNA疫苗對新(xīn)冠病毒的保護率高達94%以上,國(guó)藥傳統滅活疫苗的保護率雖遠(yuǎn)遠(yuǎn)高于WHO和FDA建議标準的50%,但不足80%,與mRNA疫苗差距明顯。
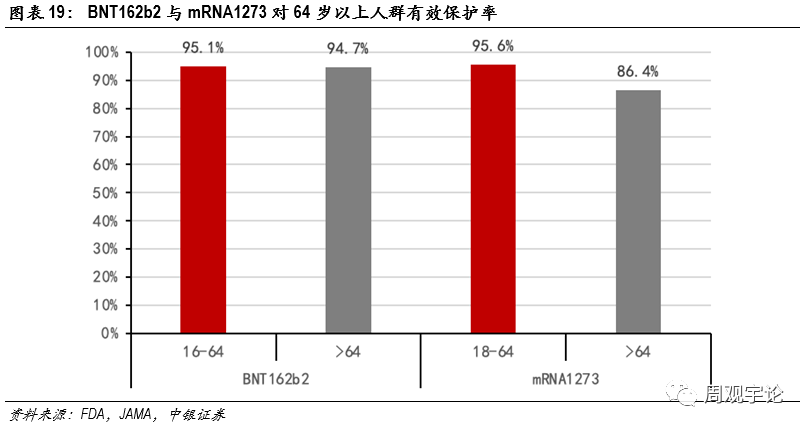
款mRNA疫苗均對64歲以上的老年人群展現了非常可(kě)觀的保護率。BioNTech的BNT162b2對64歲以上群體(tǐ)的保護率為(wèi)94.7%,僅比16-64歲群體(tǐ)數據低0.4%。Moderna的mRNA1273對64歲以上人群的保護率也高達86.4%,仍舊高于滅活疫苗的整體(tǐ)數據。
 mRNA疫苗嚴重/緻命性不良反應罕見但需關注
mRNA疫苗嚴重/緻命性不良反應罕見但需關注mRNA疫苗的各項不良反應發生率都較為(wèi)明顯地高出滅活疫苗對應水平,會讓接種者在短期内産(chǎn)生更多(duō)的不适感。但在臨床試驗中(zhōng)并未出現嚴重甚至緻命性的不良反應。各類新(xīn)冠疫苗在真實世界中(zhōng)開始運用(yòng)後,不出意外地,開始出現一些此前在實驗階段未曾出現的不良反應,例如血栓伴血小(xiǎo)闆減少症候群、心肌炎和心包炎等。根據美國(guó)CDC和FDA數據,截至2021年6月21日,美國(guó)共有(yǒu)3款新(xīn)冠疫苗可(kě)供使用(yòng),分(fēn)别為(wèi)2款mRNA疫苗(輝瑞/BioNTech、Moderna)和1款病毒載體(tǐ)疫苗(強生/楊森)。目前美國(guó)共接種3.18億劑次新(xīn)冠疫苗,其中(zhōng)病毒載體(tǐ)疫苗(強生)接種劑次超1200萬劑次,mRNA疫苗超3億劑次。綜合3款新(xīn)冠疫苗的數據,接種後發生過敏的概率為(wèi)每百萬人中(zhōng)2-5人(概率0.0002%-0.0005%)。美國(guó)疫苗不良反應報告系統(VAERS)目前接到有(yǒu)關心肌炎、心包炎的報告616起(發生概率0.0001%),CDC和FDA已确定其中(zhōng)393項,其中(zhōng)大部分(fēn)發生在mRNA疫苗接種後,發生人群集中(zhōng)在男性30歲以下的青中(zhōng)年群體(tǐ)。CDC和FDA确定了有(yǒu)關接種病毒載體(tǐ)新(xīn)冠疫苗後發生血栓伴血小(xiǎo)闆減少症候群(TTS)的報告36例(發生概率<0.0003%),接種ModernamRNA新(xīn)冠疫苗後發生TTS的報告1例。VAERS顯示接種新(xīn)冠疫苗後出現死亡案例5479例(0.0017%),其中(zhōng)是否存在和疫苗的因果關系仍需進一步觀察分(fēn)析。mRNA疫苗與滅活疫苗各有(yǒu)優勢,但不可(kě)否認的是mRNA疫苗借着新(xīn)冠疫情的契機已經展示了自己的臨床潛力,并且在研發和生産(chǎn)上也具(jù)有(yǒu)獨特的優勢,會在下文(wén)詳述。
新(xīn)冠疫情為(wèi)mRNA疫苗登上舞台帶來機遇
mRNA疫苗效果初顯,免疫屏障減緩病例新(xīn)增mRNA疫苗的臨床表現喜人,在現實生活中(zhōng),mRNA疫苗的針對新(xīn)冠病毒的有(yǒu)效保護性也得到了宏觀數據的支撐。部分(fēn)國(guó)家大規模的疫苗接種逐漸形成了一道免疫屏障,新(xīn)增新(xīn)冠感染數量有(yǒu)明顯放緩的趨勢。美國(guó)是此前新(xīn)冠疫情最為(wèi)橫行肆虐的國(guó)家。根據美國(guó)CDC數據,2020年12月美國(guó)月新(xīn)增新(xīn)冠病例619萬例;2021年1月新(xīn)增達到627萬例,累計确診2613萬例,死亡病例數44.8萬人,是世界上累計确診最多(duō),死亡病例數最多(duō)的國(guó)家。2020年12月下旬,輝瑞/BioNTech和Moderna的疫苗相繼獲得緊急使用(yòng)準入。2021年1月20日,新(xīn)任美國(guó)總統拜登上台,并于就職第二天立即簽署了數條有(yǒu)關推動疫苗接種的行政指令,并确定了“100天1億劑次接種”的目标。2021年2月,美國(guó)累計接種7524萬劑次,每一百人中(zhōng)有(yǒu)14.88人接種了至少1劑次,每一百人中(zhōng)7.41人完成了完整的疫苗接種;3月,累計接種1.48億劑次,每百人中(zhōng)有(yǒu)28.72人接種至少一劑,15.97人完成完整接種。相應地,美國(guó)2月新(xīn)增新(xīn)冠病例數下跌至251萬例,降幅約60.0%;3月進一步下降至175萬例,降幅約30.3%。數據直觀地反映了疫苗接種率與新(xīn)增新(xīn)冠病例數之間相反的關系。雖然新(xīn)增病例數的下降有(yǒu)許多(duō)其他(tā)因素,但是新(xīn)冠疫苗毫無疑問是新(xīn)增數量腰斬的一大主要因素,同時非常明顯地抑制了美國(guó)的第三波疫情。
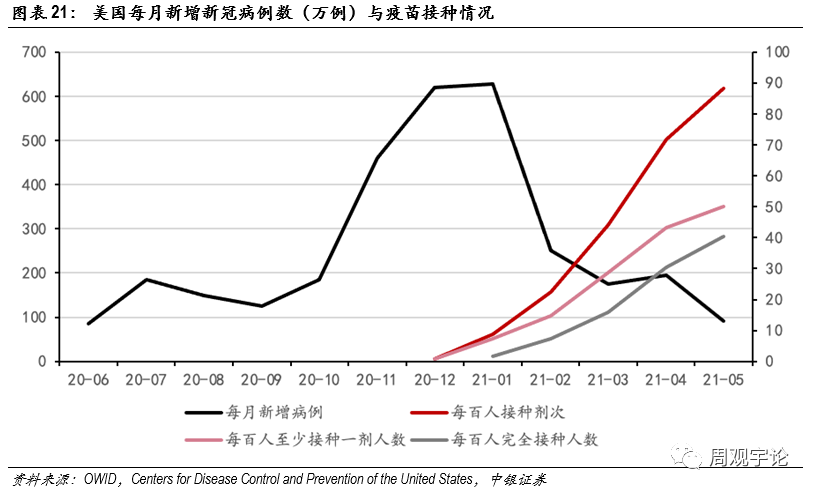 短期:國(guó)産(chǎn)mRNA疫苗應聚焦海外放量
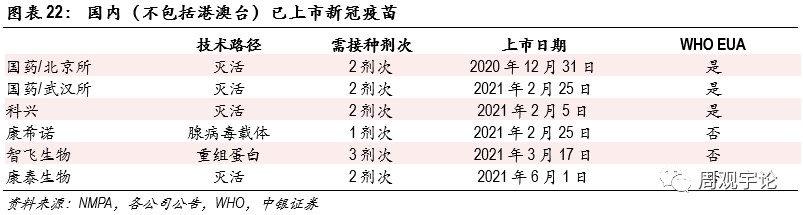
短期:國(guó)産(chǎn)mRNA疫苗應聚焦海外放量新(xīn)冠疫情爆發後,國(guó)内各科(kē)研機構、企業迅速響應,開始研發針對新(xīn)冠病毒的疫苗,并且在短短不到兩年的時間内取得了亮眼的成績。截至2021年6月4日,國(guó)内獲批上市的疫苗包括國(guó)藥與北京生物(wù)、武漢生物(wù)研制的滅活疫苗、科(kē)興的滅活疫苗、康泰生物(wù)的滅活疫苗、康希諾的腺病毒載體(tǐ)疫苗、智飛生物(wù)的重組蛋白疫苗。
短期内,國(guó)内新(xīn)冠疫苗市場已被傳統的滅活疫苗占據。截至2021年6月4日,國(guó)内疫苗接種劑次已達7億劑次。18-59歲年齡層為(wèi)新(xīn)冠疫苗适齡人群,以2020年第七次全國(guó)人口普查數據為(wèi)标準,我國(guó)15-59歲人口約8.94億人。大部分(fēn)适齡人群已接受第一劑注射。大部分(fēn)疫苗需要多(duō)次接種完成完整的免疫過程,在此過程中(zhōng),接種同一廠家或技(jì )術路徑的疫苗能(néng)夠較為(wèi)穩妥地實現免疫激活的既定目标。目前沒有(yǒu)已完成的臨床試驗可(kě)以證實接種不同技(jì )術路徑的疫苗的安(ān)全性,或是能(néng)夠達到預定的免疫效果。因此,後續疫苗很(hěn)大可(kě)能(néng)仍會按照同一廠家同一路徑完成接種,短期内mRNA新(xīn)冠疫苗在國(guó)内市場的空間有(yǒu)限。雖然國(guó)内市場已較為(wèi)飽和,但與此同時,海外疫情持續發酵。2021年3月,全球新(xīn)增新(xīn)冠确診人數1404萬例,4月新(xīn)增2319萬例,累計确診人數也一路飙升。
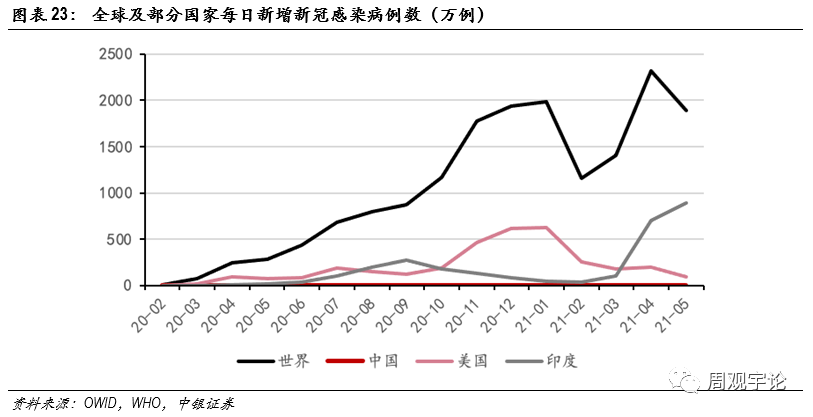
美國(guó)疫情控制已經證實了疫苗帶來的免疫屏障能(néng)夠有(yǒu)效降低新(xīn)增病例數,建立覆蓋全球的免疫屏障是世界經濟重回正常的必經之路。由于全球新(xīn)冠疫苗獲WHO緊急使用(yòng)的種類少,且産(chǎn)能(néng)有(yǒu)限,疫苗仍舊處于緊缺狀态,尤其是經濟科(kē)技(jì )相對落後的發展中(zhōng)國(guó)家。2021年5月,全球新(xīn)冠疫苗累計接種19.07億劑次,每百人中(zhōng)接種至少1劑次的約10.73人。根據世界銀行數據,2019年全球15-64歲人群占比65.252%,若不考慮患有(yǒu)基礎疾病無法接種的人群,則适齡人群中(zhōng)每百人未接種任何疫苗的人數為(wèi)54.522人。全球人口為(wèi)77.95億,則未接種任何新(xīn)冠疫苗的适齡人數約為(wèi)42.50億人,以每人2劑次折算,則理(lǐ)論空間為(wèi)85.00億劑次。全球疫苗産(chǎn)能(néng)緊張,擁有(yǒu)疫苗技(jì )術和生産(chǎn)能(néng)力的國(guó)家十分(fēn)有(yǒu)限,許多(duō)國(guó)家無法得到疫苗,尤其是經濟科(kē)技(jì )較為(wèi)落後的發展中(zhōng)國(guó)家。因此,新(xīn)冠疫苗的海外市場有(yǒu)非常巨大的發展空間。
中(zhōng)長(cháng)期:病毒變異或削弱一代疫苗效力,mRNA疫苗可(kě)快速反應應對變異新(xīn)冠的大範圍傳播增加了病毒變異的可(kě)能(néng)性。現有(yǒu)疫苗能(néng)否防範變異病毒成為(wèi)社會關心的熱點之一。普通群衆對疫苗有(yǒu)效性感到擔憂,投資者則關心是否會影響現有(yǒu)疫苗的放量情況。針對這一問題,mRNA疫苗效力遭到削弱的幅度有(yǒu)限,而對于傳統滅活疫苗将會是一個嚴峻挑戰。
病毒變異對現有(yǒu)mRNA疫苗的影響有(yǒu)限,幾乎沒有(yǒu)可(kě)能(néng)出現使疫苗完全失效的情況。現有(yǒu)mRNA疫苗以新(xīn)冠病毒的刺突蛋白(S蛋白)為(wèi)抗原,人體(tǐ)産(chǎn)生的特異免疫會以刺突蛋白為(wèi)标志(zhì)物(wù),對表達此蛋白的細胞分(fēn)子發動攻擊。因此,若刺突蛋白沒有(yǒu)發生顯著變異,疫苗激活的特異免疫仍能(néng)夠識别病毒,病毒其他(tā)部分(fēn)發生變異并不會影響這一識别過程。而刺突蛋白發生明顯變異并使病毒維持相同感染能(néng)力的幾率較小(xiǎo)。刺突蛋白是新(xīn)冠病毒打開人體(tǐ)細胞的鑰匙,人體(tǐ)細胞上的對應受體(tǐ)則是鎖孔,隻有(yǒu)當鑰匙與鎖孔匹配時才能(néng)打開細胞的大門。若鑰匙形狀明顯改變(刺突蛋白發生明顯變異),則大概率無法與鎖孔匹配,也就無法入侵細胞。因此,刺突蛋白變異會改變病毒的感染機理(lǐ),大概率造成病毒感染能(néng)力喪失或減弱。通過錨定S蛋白,mRNA疫苗仍舊維持了部分(fēn)針對變異病毒的保護性。長(cháng)期來看,mRNA疫苗也需要更新(xīn)叠代,以更精(jīng)準地适應新(xīn)型變異病毒。mRNA疫苗的一大優勢是可(kě)以通過簡單的修改基因序列來産(chǎn)生不同的抗原。若病毒序列變異導緻現有(yǒu)疫苗有(yǒu)效率明顯下滑,mRNA疫苗廠商(shāng)可(kě)以通過重新(xīn)對病毒測序來确定變異後的刺突蛋白序列,并以此制成新(xīn)的疫苗。此外,mRNA疫苗可(kě)以同時包含針對多(duō)種不同病毒亞型的對應編碼,達到同時激發幾種特異免疫的效果。
滅活疫苗依靠失去活性的整個病毒激發免疫反應。因此産(chǎn)生的免疫記憶并不錨定S蛋白,而是針對病毒攜帶的任意一種或多(duō)種抗原,因此每個接種者産(chǎn)生的特異免疫都不盡相同。因此,但病毒發生變異時,此前作(zuò)為(wèi)病毒識别抓手的抗原有(yǒu)可(kě)能(néng)發生改變,導緻免疫系統無法識别出病毒。
國(guó)内大規模接種的疫苗品種為(wèi)滅活疫苗,根據上文(wén)分(fēn)析,以SARS-CoV-2病毒為(wèi)目标靶點的第一代滅活疫苗在應對病毒的不斷變異中(zhōng),效力會出現下降,造成免疫逃逸的風險。同時,目前公(gōng)認的滅活疫苗的保護期約6個月,根據我國(guó)新(xīn)冠疫苗接種劑次趨勢,2021年底将出現第二輪新(xīn)冠疫苗的需求潮。國(guó)内新(xīn)冠疫苗接種次數趨勢如下:2021年3月27日突破1億劑次、4月21日突破2億劑次、5月9日突破3億劑次、5月16日突破4億劑次、5月24日突破5億劑次、5月30日突破6億劑次、6月3日突破7億劑次、6月8日突破8億劑次、6月15日突破9億劑次、6月20日突破10億劑次。每增加1億劑次的間隔分(fēn)别為(wèi)25天、18天、7天、8天、6天、4天、4天、7天、5天,基本呈現出加速趨勢。根據全國(guó)第七次人口普查結果,15-59歲人口約8.94億人。以完整免疫需要接種2劑次新(xīn)冠疫苗為(wèi)标準,我國(guó)本輪新(xīn)冠疫苗需求量約17.88億劑次。

由于缺失大部分(fēn)數據,我們無法得知數據中(zhōng)有(yǒu)多(duō)少人已完成整套接種。僅有(yǒu)2021年6月10日當日數據提到截至當日完成整套接種流程的人數,約為(wèi)2.233億人。以2劑次為(wèi)标準,折算為(wèi)4.466億劑次,截至當日全國(guó)接種劑次總數為(wèi)8.45億劑次,用(yòng)于完成整套接種的劑次數占總接種劑次數的26.42%。按照6個月保護期計算,截至2021年12月10日左右将有(yǒu)2.233億人需要第二輪新(xīn)冠疫苗接種。根據2021年6月10日數據,截至當日接種了一劑次的人數為(wèi)3.984億人,這一部分(fēn)群體(tǐ)在2021年7月10日前将接種第二劑次,并且在2022年1月10日前開始進行第二輪的接種,屆時國(guó)内市場将有(yǒu)約4億劑次的新(xīn)需求。
mRNA疫苗生産(chǎn)流程
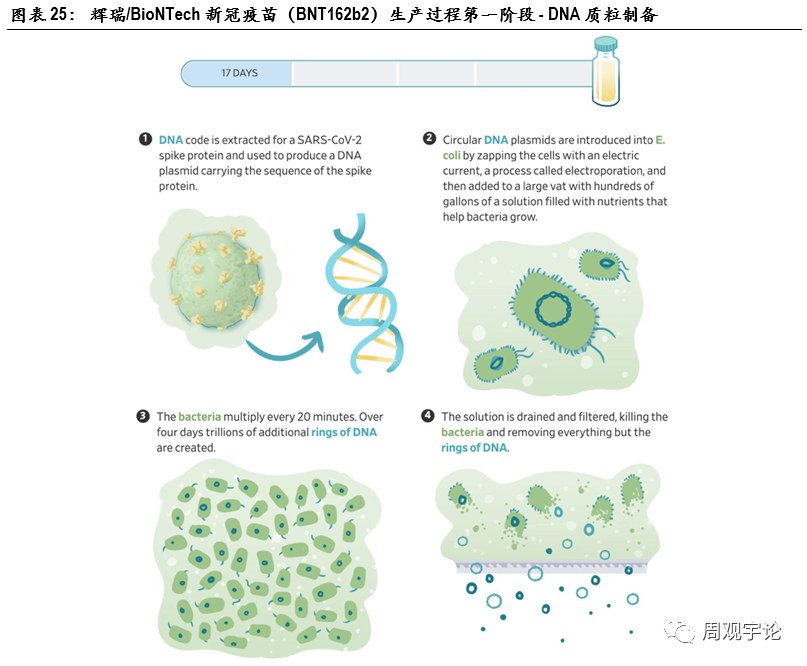
第一步:DNA質(zhì)粒制備mRNA疫苗的生産(chǎn)可(kě)分(fēn)為(wèi)三大階段,一是DNA原液制備,二是mRNA原液的制備,三是利用(yòng)脂質(zhì)微粒進行包封。在此,我們以輝瑞/BioNTech新(xīn)冠疫苗BNT162b2的生産(chǎn)流程為(wèi)例進行闡述。原液制備開始于質(zhì)粒構建。通常使用(yòng)的DNA質(zhì)粒為(wèi)環狀質(zhì)粒,質(zhì)粒上含有(yǒu)設計好的序列模塊,其中(zhōng)包括刺突蛋白編碼。利用(yòng)電(diàn)流打破細胞膜,并将環狀DNA質(zhì)粒引入大腸杆菌。此後,大腸杆菌被儲藏于含有(yǒu)大量營養物(wù)質(zhì)的溶液中(zhōng)進行繁殖擴增。大腸杆菌每20分(fēn)鍾分(fēn)裂一次,4天内可(kě)以得到數萬億DNA質(zhì)粒。提取并純化DNA質(zhì)粒,過濾溶液,去除細菌及其他(tā)物(wù)質(zhì)。利用(yòng)酶将純化後的環狀DNA質(zhì)粒切割為(wèi)鏈狀。将所得溶液分(fēn)裝(zhuāng)冷藏,通過質(zhì)量控制環節,并運送至下一階段的生産(chǎn)加工(gōng)場所。此階段生産(chǎn)過程耗時10天,若将質(zhì)控和運輸環節納入考慮則共耗時約17天。
 第二步:體(tǐ)外轉錄
第二步:體(tǐ)外轉錄第二階段的目的是将DNA鏈轉化為(wèi)mRNA。上一步制備得到的DNA鏈與酶和核苷酸混合在10加侖容量的容器中(zhōng),RNA聚合酶(RNA polymerase)會将DNA轉錄為(wèi)mRNA。這一步驟被稱為(wèi)體(tǐ)外轉錄(IVT)。得到mRNA後,DNA以及其他(tā)物(wù)質(zhì)将被濾除,mRNA被裝(zhuāng)進購(gòu)物(wù)袋大小(xiǎo)的塑料包裝(zhuāng)中(zhōng),每袋含有(yǒu)約500萬到1000萬劑次的mRNA原料。經過經過質(zhì)量控制和運輸到達下一生産(chǎn)環節,這一階段的生産(chǎn)耗時約4天,質(zhì)量控制和運輸耗時12天,共16天。
 第三步:遞送系統裝(zhuāng)載
第三步:遞送系統裝(zhuāng)載第三階段的流程目的是将mRNA包裹進脂質(zhì)載體(tǐ)(LNP)中(zhōng)。脂質(zhì)懸浮于酒精(jīng)溶液中(zhōng),與mRNA接觸并将其包裹,兩種物(wù)質(zhì)通過相反電(diàn)荷相吸引。之後,原液經過切向流過濾(TFF)濾除溶液中(zhōng)多(duō)餘的脂質(zhì)、酒精(jīng)等雜質(zhì),并制成最終的mRNA疫苗溶液。此生産(chǎn)過程耗時約12天。輝瑞目前在一家位于密歇根的工(gōng)廠進行這一階段的生産(chǎn),生産(chǎn)場地面積僅相當于一個能(néng)容納一輛汽車(chē)的車(chē)庫大小(xiǎo)。場地内有(yǒu)100台混液裝(zhuāng)置工(gōng)作(zuò),在30小(xiǎo)時内制造了300萬劑次的疫苗原液。此階段是mRNA疫苗生産(chǎn)的最大瓶頸之一,其中(zhōng)一個重要原因是市場上提供脂質(zhì)的廠商(shāng)有(yǒu)限,因此輝瑞已開始自主研發制造脂質(zhì)。但其中(zhōng)涉及的專利等問題仍舊為(wèi)這一階段的放大生産(chǎn)蒙上了一層陰影。
 第四步:灌裝(zhuāng)檢驗
第四步:灌裝(zhuāng)檢驗在上述三個生産(chǎn)階段都完成後,mRNA疫苗原液已完成,隻待灌裝(zhuāng)分(fēn)發。輝瑞一管容器中(zhōng)包含6劑次的疫苗原液量。輝瑞位于密歇根州的工(gōng)廠能(néng)夠在2天内完成100萬劑次的灌裝(zhuāng)。随後,經過2周的純淨度檢測及其他(tā)安(ān)全性檢測,疫苗便能(néng)銷往世界各地。此過程共花(huā)費約19天。以上所有(yǒu)生産(chǎn)灌裝(zhuāng)環節耗時約64天。
mRNA疫苗兩大核心競争力:序列結構、遞送系統
以上我們分(fēn)析了mRNA疫苗對于需求端相較于其他(tā)技(jì )術路徑疫苗的優勢與不足,可(kě)以确定的是,mRNA在需求端的吸引力正在不斷上升。那麽在供給端,決定mRNA疫苗競争格局的要點與瓶頸集中(zhōng)在兩大因素上:mRNA序列結構和疫苗遞送系統。
mRNA序列結構決定抗原蛋白結構、免疫原性及穩定性
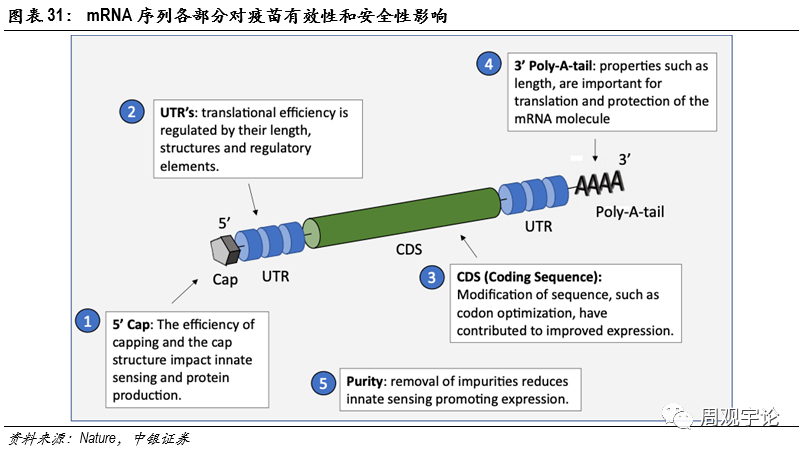
疫苗産(chǎn)生的抗原蛋白的序列以及穩定性決定了其激活的特異免疫的精(jīng)确性和活性。而抗原蛋白的序列和結構則由mRNA序列影響和控制。因此,mRNA序列決定了疫苗的質(zhì)量,也是mRNA疫苗廠商(shāng)的核心競争力之一。上文(wén)中(zhōng)提到生物(wù)學(xué)“中(zhōng)心法則”:DNA轉錄為(wèi)mRNA轉譯為(wèi)蛋白質(zhì)。事實上,mRNA中(zhōng)隻有(yǒu)部分(fēn)片段會成為(wèi)組成蛋白質(zhì)的序列,其餘部分(fēn)則控制調節蛋白質(zhì)的轉譯效率和結構。mRNA序列中(zhōng),最終被轉譯成為(wèi)蛋白質(zhì)組成序列的部分(fēn)被稱為(wèi)編碼區(qū)域(translatedregion),編碼區(qū)域前後分(fēn)别有(yǒu)一個非轉譯區(qū)(untranslated region,UTR)。編碼區(qū)域決定了蛋白質(zhì)中(zhōng)的氨基酸序列。編碼區(qū)域中(zhōng)三個堿基為(wèi)一組,稱為(wèi)密碼子(codon)。密碼子經轉譯成為(wèi)特定的氨基酸,氨基酸串聯後形成肽鏈,結構化後成為(wèi)蛋白質(zhì)。部分(fēn)密碼子組合會轉譯成同一種氨基酸(同義密碼子Synonymouscodon),但在不同生物(wù)族群中(zhōng),會存在對某一密碼子組的偏好,此密碼子組合的免疫原性較小(xiǎo),不易遭到酶類的攻擊,而它的同義密碼子則可(kě)能(néng)引起過敏反應并且導緻質(zhì)量下降。例如CAA、CAG均對應谷氨酰胺(Gln),但人類基因組中(zhōng)使用(yòng)CAG更頻繁,頻率達到73%。因此CAA相較而言更有(yǒu)可(kě)能(néng)觸發免疫反應。因此,mRNA疫苗需要選擇最接近人源性的同義密碼子,規避可(kě)能(néng)引起過敏反應的組合以保證安(ān)全性和轉譯質(zhì)量。非轉譯區(qū)則調控mRNA和蛋白質(zhì)的穩定性以及表達效率。

mRNA序列是疫苗研發中(zhōng)的重點,也是行業内競争的核心。除了含有(yǒu)抗原蛋白編碼外,序列其他(tā)部分(fēn)也直接影響mRNA疫苗的質(zhì)量。編碼前後的非轉譯區(qū)(UTR)負責調控轉譯以及蛋白表達,對mRNA的轉譯效率、半衰期、最高表達水平等數值有(yǒu)影響。轉譯效率可(kě)用(yòng)來推斷相同單位mRNA疫苗産(chǎn)生抗原的速度、半衰期用(yòng)以推斷mRNA能(néng)夠産(chǎn)生抗原蛋白的時間、表達累計最高水平用(yòng)以推斷每單位mRNA在某一時刻能(néng)産(chǎn)生的抗原量的最高水平。同時,UTR中(zhōng)的GC水平、U水平均會影響mRNA的免疫原性,對疫苗的安(ān)全性和能(néng)否正常産(chǎn)生抗原造成影響。UTR需要在DNA質(zhì)粒建立時包含在序列中(zhōng),屬于序列設計的一部分(fēn)。3’端多(duō)聚A尾(poly-A tail;A指腺苷,4種基礎核苷酸的一種)位于mRNA尾部3’端,長(cháng)度約100-250單位。多(duō)聚A尾能(néng)夠提高mRNA的穩定性和轉譯效率。腺苷(A)能(néng)夠降低核糖核酸酶(RNases)的效率,以此減緩mRNA的降解速度。多(duō)聚A尾可(kě)在建立DNA質(zhì)粒時直接包含于編碼中(zhōng),也可(kě)在DNA轉錄為(wèi)mRNA後通過聚合酶(poly-A polymerase,PAP)添加于mRNA尾部。
同時,位于mRNA最前端的5’帽結構對于降低mRNA免疫原性,增強穩定性和翻譯效率有(yǒu)正面影響。5’帽結構是一個位于mRNA序列之前的反向7-甲基鳥苷(m7G)。在體(tǐ)外轉錄(IVT)過程中(zhōng),mRNA5’端會含有(yǒu)三磷酸鹽部分(fēn),具(jù)有(yǒu)很(hěn)強的免疫原性。若不去除這一部分(fēn),當mRNA被遞送進入人體(tǐ)細胞後,mRNA會在細胞質(zhì)中(zhōng)引起IFN-1免疫反應,無法在人體(tǐ)内正常轉譯産(chǎn)生蛋白抗原。加帽過程可(kě)在DNA轉錄為(wèi)mRNA的生産(chǎn)過程中(zhōng)或過程後進行,利用(yòng)抗反向帽類似物(wù)(ARCA)将5’帽結構按正确方向固定在mRNA的5’端。但是此過程不能(néng)保證三磷酸鹽完全被去除,所以仍舊存在引起細胞内免疫反應的風險,因此加帽工(gōng)藝對疫苗的安(ān)全性有(yǒu)直接影響。
 遞送系統是目前産(chǎn)能(néng)擴張的瓶頸
遞送系統是目前産(chǎn)能(néng)擴張的瓶頸
LNP作(zuò)為(wèi)遞送介質(zhì)的工(gōng)作(zuò)原理(lǐ)已在上文(wén)闡述。作(zuò)為(wèi)mRNA疫苗的傳遞介質(zhì)的一大難點是mRNA以内含體(tǐ)的形式進入細胞質(zhì)後,需要打破内含體(tǐ)包膜,釋放mRNA。目前LNP供應商(shāng)較少,且其中(zhōng)專利糾紛因此成為(wèi)mRNA新(xīn)冠疫苗快速放量的一大掣肘。目前輝瑞/BioNTech以及Moderna所使用(yòng)的LNP專利都來源于一家名(míng)為(wèi)Arbutus的加拿(ná)大生物(wù)公(gōng)司。Arbutus将其部分(fēn)LNP專利租借給另外兩家公(gōng)司Acuitas和Genevant,而這兩家公(gōng)司分(fēn)别為(wèi)Moderna和BioNTech的LNP專利來源。

Acuitas于2013年取得了來自Arbutus的LNP授權,而後Acuitas又(yòu)将此授權進一步轉租給Moderna公(gōng)司。2016年,Arbutus與Acuitas針對這一再授權行為(wèi)在加拿(ná)大法庭展開了一次長(cháng)達2年的司法訴訟。2018年這場訴訟畫上了句号,最終的訴訟結果是:“Acuitas轉讓給Moderna的4項非排他(tā)性疫苗授權是僅有(yǒu)的可(kě)以繼續留存的合法授權,且此4項授權隻能(néng)用(yòng)于特定的病毒靶點。”然而,Moderna公(gōng)司并不滿意此次判決,公(gōng)司接連發起3項針對Arbutus的專利訴訟(IPR):
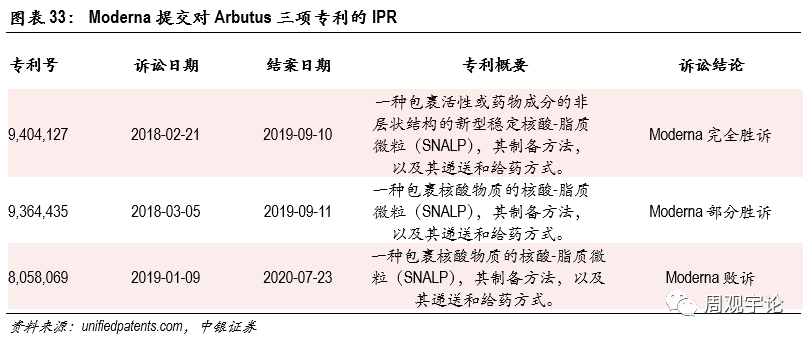
除Moderna外,另一大mRNA廠商(shāng)CureVac在2016年也從Acuitas獲得了LNP相關授權,目前暫未顯示CureVac被卷入相關的訴訟中(zhōng)。根據ipwatchdog的報道,2020年7月CureVac的SEC F-1登記表中(zhōng)表明此授權協議仍舊有(yǒu)效,因此CureVac與Acuitas的協議可(kě)能(néng)并不涉及來自Arbutus的再許可(kě)。
Arbutus及其最大控股股東Roivant于2018年4月剝離了Genevant公(gōng)司,同時Arbutus将非HBV的LNP技(jì )術專利授權給Genevant公(gōng)司,授權中(zhōng)包含了Moderna敗訴的‘069專利。作(zuò)為(wèi)回報,Arbutus獲得Genevant公(gōng)司40%股權(另60%股權屬于Roivant公(gōng)司)。2018年7月,BioNTech于Genevant公(gōng)司簽訂了一份授權及共同開發協議。據稱此協議可(kě)能(néng)包括了後續Moderna申訴的‘069專利。同時,Genevant和BioNTech公(gōng)司共同承擔專利保護權。
BioNTech和Moderna的新(xīn)冠疫苗中(zhōng)的LNP技(jì )術專利全部來自Arbutus。Moderna在新(xīn)冠疫苗中(zhōng)使用(yòng)的LNP技(jì )術大概率不包含在Acuitas被許可(kě)再授權的4個項目中(zhōng),因此後續是否會再次引起法律糾紛仍未可(kě)知。BioNTech從與Genevant合作(zuò)中(zhōng)獲得的LNP授權則會受到Moderna訴訟的影響。在其他(tā)載體(tǐ)均有(yǒu)明顯劣勢的情況下,LNP是mRNA疫苗遞送的最佳選擇之一。因此,各廠商(shāng)對LNP技(jì )術的掌握以及是否擁有(yǒu)相關專利成為(wèi)了業内競争中(zhōng)極其重要的一環。廠商(shāng)若無相關專利,則在競争中(zhōng)會處于被“卡脖子”的尴尬境地。因此,LNP技(jì )術專利決定了mRNA疫苗企業在業内競争中(zhōng)的地位。
mRNA疫苗有(yǒu)望為(wèi)腫瘤免疫疾病控制帶來新(xīn)曙光
mRNA疫苗屬性契合腫瘤免疫疾病控制需求腫瘤以及免疫疾病一直是人類健康面對的重大挑戰,科(kē)學(xué)家不斷地尋找能(néng)夠減緩乃至根治腫瘤或免疫疾病的治療方法。在治療後,如何預防控制此類疾病的複發也是其中(zhōng)的重點課題之一。mRNA疫苗有(yǒu)可(kě)能(néng)給這個懸而未決的問題帶來新(xīn)解法。
mRNA疫苗能(néng)夠激發針對細胞的T細胞免疫mRNA疫苗除激活B細胞抗體(tǐ)免疫之外,還能(néng)夠激活T細胞抗體(tǐ)。在殺傷腫瘤細胞方面,T細胞擁有(yǒu)更高的效率。mRNA疫苗通過自身細胞短暫持續産(chǎn)生外源蛋白,持續性地訓練加強特異免疫。持續性訓練能(néng)夠使人體(tǐ)内的記憶免疫細胞(包括B記憶細胞和T記憶細胞)維持在相對較高的水平。由于記憶免疫細胞基數大,在遇到目标抗原時,抗體(tǐ)和殺手T細胞的擴增速度也會大大提升,能(néng)夠更快速地反應。
mRNA疫苗能(néng)夠更精(jīng)準地靶向特異免疫目标腫瘤或免疫疾病會分(fēn)泌獨有(yǒu)的特定的抗原标識物(wù),稱為(wèi)腫瘤相關抗原(TAA),我們可(kě)以篩選出此類抗原進行測序、分(fēn)析,将無毒害部分(fēn)逆轉譯為(wèi)對應的mRNA序列。将此mRNA制成疫苗,使自身細胞生産(chǎn)出抗原标識物(wù),并以此激發對應的特異性免疫。由于mRNA疫苗中(zhōng)的編碼可(kě)以進行編輯,可(kě)以準确地控制産(chǎn)生的抗原蛋白種類和序列,選擇僅僅在腫瘤細胞中(zhōng)才會分(fēn)泌的抗原蛋白标志(zhì)物(wù)作(zuò)為(wèi)靶點,避免誤傷其他(tā)正常細胞,使特異免疫精(jīng)準地靶向腫瘤。
mRNA腫瘤疫苗研發情況目前全球領先的三大mRNA疫苗企業分(fēn)别為(wèi):Moderna、BioNTech、CureVac。
(1)ModernaModerna成立于2010年,總部位于美國(guó)馬薩諸塞州劍橋市,位于美國(guó)兩大生物(wù)技(jì )術熱點地區(qū)之一,毗鄰MIT、哈佛大學(xué)。公(gōng)司使命為(wèi):将mRNA科(kē)學(xué)兌現,為(wèi)患者創造新(xīn)一代變革藥物(wù)(Deliver on the promise of mRNA scienceto create a new generation of transformative medicines for patients.)。
- 技(jì )術平台助力序列研發,多(duō)平台全面支持科(kē)學(xué)家研發工(gōng)作(zuò)。
Moderna擁有(yǒu)從研究發現到早期開發的技(jì )術平台。研究平台中(zhōng),SOFTWAREOF LIFE™ 使科(kē)學(xué)家能(néng)夠将想法推進至開發階段,為(wèi)這一進程提供支持服務(wù),其中(zhōng)包括能(néng)夠快速大量提供mRNA的設備,讓科(kē)學(xué)家能(néng)夠進行大量實驗。mRNA DesignStudio™利用(yòng)算法為(wèi)mRNA的序列設計賦能(néng)。此平台能(néng)夠通過靶向蛋白反向模拟mRNA序列,并通過公(gōng)司的生物(wù)信息算法進行自動優化。科(kē)學(xué)家也可(kě)通過手動編輯更改mRNA序列。通過積累大量的數據,mRNA Design Studio™能(néng)夠不斷升級進化mRNA設計算法,為(wèi)之後的研發提供更大的幫助。公(gōng)司早期開發平台mRNA EARLYDEVELOPMENT ENGINE™能(néng)夠提供例如工(gōng)藝開發、GLP毒理(lǐ)研究、全球監管溝通、臨床試驗準備及運行的能(néng)力。平台将候選藥物(wù)繼續推進至GLP毒理(lǐ)、人類概念驗證(PoC)階段。目前Moderna在馬薩諸塞州諾伍德(dé)有(yǒu)一家cGMP臨床中(zhōng)心,占地面積約20萬平方英尺,每年能(néng)進行超過100批次cGMP,能(néng)夠進行GLP毒理(lǐ)研究以及臨床I期、II期。同時,公(gōng)司在諾伍德(dé)集中(zhōng)了生産(chǎn)所需的環節,包括原材料和活性藥物(wù)成分(fēn)(API)的生産(chǎn)、配方設計、灌裝(zhuāng)等能(néng)力。這一集群優勢使研發工(gōng)作(zuò)能(néng)夠快速推進。
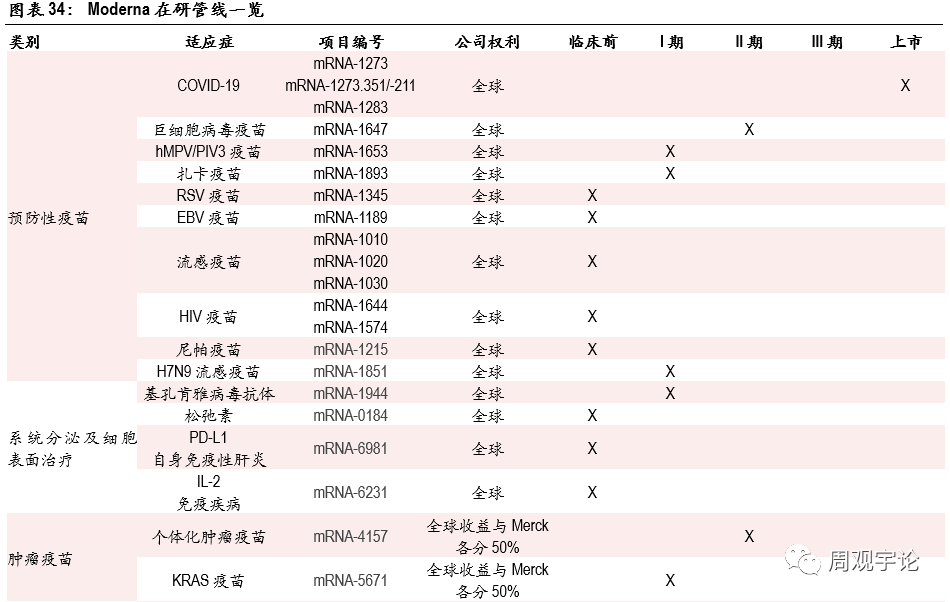
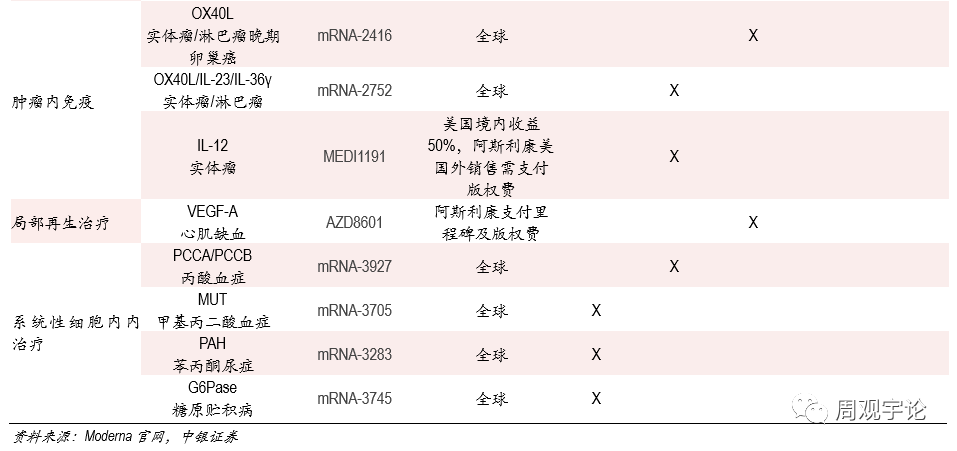
- 研發管線(xiàn)包括預防性與治療性疫苗,引領疫苗應用(yòng)新(xīn)時代的到來。
Moderna目前擁有(yǒu)24個疫苗研發項目,其中(zhōng)包括了預防性疫苗,例如新(xīn)冠疫苗、紮卡病毒疫苗等,以及治療性疫苗(主要為(wèi)腫瘤疫苗)。
 (2)BioNTech
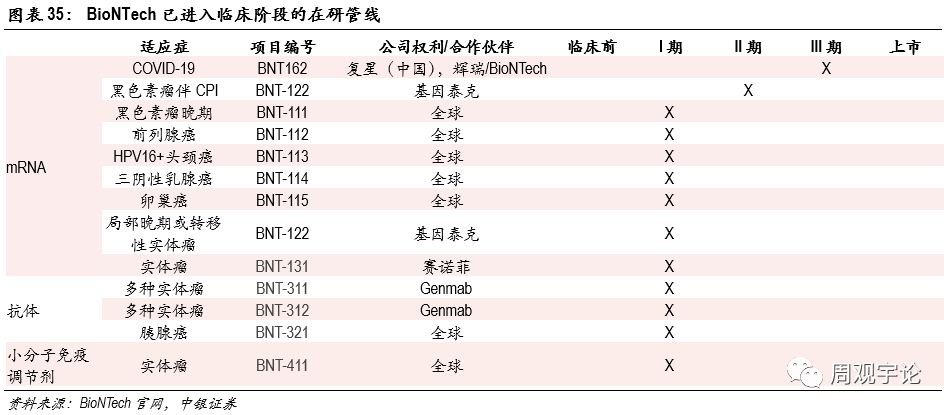
(2)BioNTechBioNTech成立于2008年。公(gōng)司緻力于研發個人化的免疫治療方案。公(gōng)司産(chǎn)品涵蓋了mRNA、細胞治療、抗體(tǐ)、小(xiǎo)分(fēn)子免疫調節劑等。公(gōng)司目前共有(yǒu)31個項目在研,13項進入臨床階段。
- 公(gōng)司擁有(yǒu)多(duō)個技(jì )術平台,滿足不同的患者和醫(yī)療需求。
公(gōng)司FixVac平台主要靶向在腫瘤中(zhōng)普遍有(yǒu)表達的抗原,優化mRNA序列以及RNA與遞送系統的結合。公(gōng)司另一大平台iNeST則是針對患者個體(tǐ)的研發平台。通過直接采集的患者樣本來确定腫瘤突變序列,并據此預測RNA靶點,最終為(wèi)患者提供完全個人化的免疫治療方案。除此之外,BioNTech還擁有(yǒu)許多(duō)其他(tā)平台支撐公(gōng)司提供創新(xīn)的腫瘤、免疫、傳染疾病的解決方案。
- 公(gōng)司在研管線(xiàn)集中(zhōng)于mRNA項目,同時抗體(tǐ)及小(xiǎo)分(fēn)子免疫調節劑已有(yǒu)項目進入臨床。
BioNTech目前共有(yǒu)31項在研項目,13項已進入臨床階段,其中(zhōng)包含9項mRNA治療、3項抗體(tǐ)治療、1項小(xiǎo)分(fēn)子免疫調節劑。
 (3)CureVac
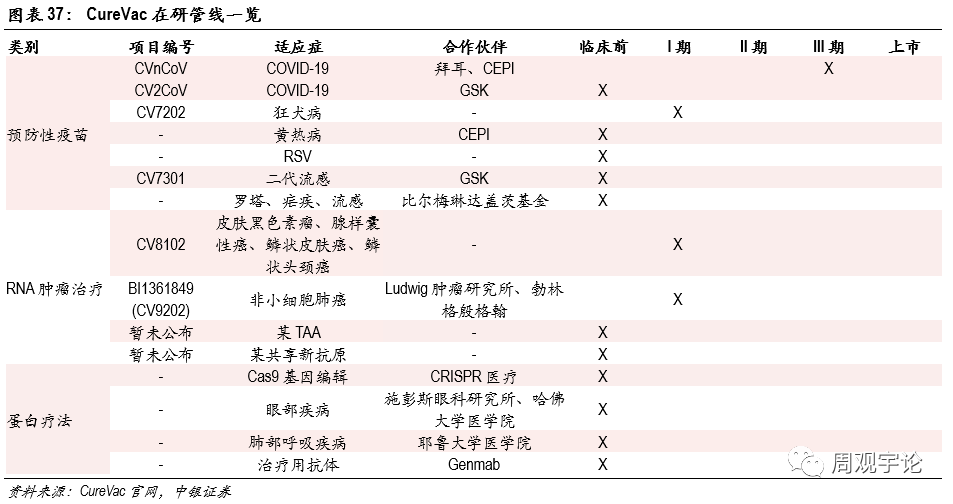
(3)CureVacCureVac成立于2000年,是全球第一家成功得到醫(yī)用(yòng)mRNA的公(gōng)司。與Moderna相似,CureVac同時布局了預防型和治療型疫苗,以及蛋白治療。公(gōng)司目前共有(yǒu)14個項目在研,4項進入臨床階段。
- 一站式mRNA治療,全面布局藥物(wù)發現至生産(chǎn)所有(yǒu)環節。
CureVac擁有(yǒu)693項專利,從藥物(wù)發現至産(chǎn)品生産(chǎn)均可(kě)在公(gōng)司内部完成。公(gōng)司擁有(yǒu)一家位于德(dé)國(guó)的GMP工(gōng)廠。同時公(gōng)司研發了流動生産(chǎn)車(chē)間The RNA Printer®,可(kě)快速應對疫情爆發,能(néng)夠緊急設置在醫(yī)院提供個人化的mRNA藥物(wù)。

CureVac于2021年6月16日公(gōng)布了公(gōng)司第一代mRNA新(xīn)冠疫苗CVnCoV的臨床IIb/III期數據。疫苗有(yǒu)效保護率僅為(wèi)約47%,并未達到設定目标。疫苗安(ān)全性則達到了預定目标。本次臨床試驗數據已提交歐洲藥物(wù)管理(lǐ)局(EMA),等待進一步分(fēn)析審核。随後,公(gōng)司于17日召開了說明會,對此次臨床數據進行分(fēn)析。分(fēn)析認為(wèi)造成第一代新(xīn)冠疫苗CVnCoV保護率不理(lǐ)想的主要原因是病毒變異。公(gōng)司對感染者所感染的新(xīn)冠病毒進行了基因分(fēn)析,發現其中(zhōng)有(yǒu)29種不同亞型的新(xīn)冠病毒存在。在開展臨床試驗的10個國(guó)家中(zhōng),歐洲地區(qū)病例91%屬于Alpha型變異株,而拉丁美洲地區(qū)有(yǒu)多(duō)種變異株流行,而公(gōng)司用(yòng)作(zuò)靶點的新(xīn)冠病毒原型(野生型)僅有(yǒu)不足1%。因此,公(gōng)司認為(wèi)病毒不斷變異對研發工(gōng)作(zuò)帶來了不小(xiǎo)的挑戰。同時,公(gōng)司也與GSK合作(zuò)開始開發第二代新(xīn)冠疫苗CV2CoV,新(xīn)一代疫苗将使用(yòng)全新(xīn)的mRNA序列,并考慮多(duō)種病毒變異亞型。從目前的實驗結果來看,二代新(xīn)冠疫苗激活免疫的速度更快,同時抗體(tǐ)滴度更高。公(gōng)司預測新(xīn)一代疫苗将于2021年第三季度進入臨床階段。另一方面,CureVac本次疫苗采用(yòng)的儲藏溫度條件為(wèi)5攝氏度,遠(yuǎn)遠(yuǎn)寬松于已上市的BNT162b2和mRNA1273。高溫條件下,疫苗遞送系統的脂質(zhì)成分(fēn)可(kě)能(néng)會發生變質(zhì)、降解,本次不太理(lǐ)想的臨床實驗數據是否與此有(yǒu)關聯是業内科(kē)學(xué)家們正在讨論的話題之一。

投資策略:國(guó)内mRNA疫苗暫時空白,關注擁有(yǒu)核心技(jì )術的企業
國(guó)内暫未有(yǒu)mRNA獲批上市,這一市場目前仍處于空白狀态。在第二輪新(xīn)冠疫苗需求到來之際,國(guó)産(chǎn)mRNA疫苗的競争将會打響。根據上文(wén)所提,mRNA疫苗的兩大核心是序列設計和遞送系統,因此,我們建議重點關注同時擁有(yǒu)這兩大核心技(jì )術的企業。目前國(guó)内市場中(zhōng),mRNA疫苗研發進展最快的是艾博生物(wù)與沃森生物(wù)、軍科(kē)院共同研發的ARCoV,以及複星醫(yī)藥由BioNTech引進的BNT162b2。因此,我們推薦沃森生物(wù)以及取得了BioNTechmRNA新(xīn)冠疫苗大中(zhōng)華區(qū)權利的複星醫(yī)藥。國(guó)内已有(yǒu)8家研發型mRNA疫苗企業,目前均處于起步階段。在認可(kě)mRNA疫苗潛力的前提下,建議留意各公(gōng)司的研發及融資進展。我們建議關注斯微生物(wù)和麗凡達生物(wù)。同時,我們也建議關注在疫苗領域擁有(yǒu)豐富臨床申報、生産(chǎn)制造、銷售能(néng)力的企業,這些企業有(yǒu)望與研發企業開展緊密的合作(zuò),優勢互補,并及時跟緊疫苗技(jì )術發展的潮流。
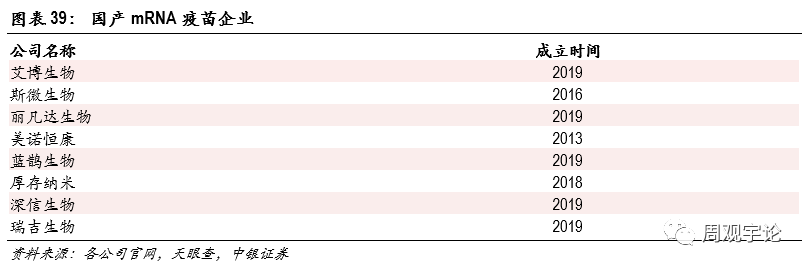 風險提示
風險提示研發進展不及預期、銷售不及預期、監管政策收緊風險。
沃森生物(wù)
深耕疫苗行業,緻力于打造中(zhōng)國(guó)第一款國(guó)産(chǎn)mRNA疫苗支撐評級的要點攜手艾博生物(wù)打造第一款國(guó)産(chǎn)mRNA疫苗。5月11日,公(gōng)司公(gōng)告與蘇州艾博生物(wù)簽署關于新(xīn)冠mRNA疫苗的合作(zuò)協議。艾博生物(wù)具(jù)有(yǒu)mRNA疫苗設計的核心技(jì )術,其CEO英博先生曾供職于國(guó)際mRNA疫苗巨頭Moderna。沃森生物(wù)則擁有(yǒu)臨床注冊、研究、産(chǎn)業化和營銷方面的豐富經驗。同日,墨西哥(gē)宣布将在5月底開展此疫苗的III期臨床試驗。
聚焦前沿技(jì )術,提前布局新(xīn)一代核酸類藥物(wù)。4月27日,上市公(gōng)司與聖諾生物(wù)簽署了抗病毒核酸幹擾藥物(wù)的合作(zuò)協議。聖諾生物(wù)負責完成藥物(wù)的臨床申報所需的臨床前研究,公(gōng)司獲得該藥物(wù)在中(zhōng)國(guó)大陸及港澳台地區(qū)的獨家權利。
13價肺炎疫苗開始貢獻收入,國(guó)際化銷售錦上添花(huā)。2021Q1,子公(gōng)司13價肺炎疫苗獲批簽發164.3萬瓶,達到2020年全年批簽發量的36.8%。同時,子公(gōng)司與摩洛哥(gē)MarocVax達成排他(tā)性協議。MarocVax保證在收到完整産(chǎn)品注冊檔案後18個月内獲得上市許可(kě)。2021年,此疫苗于摩洛哥(gē)的銷量約為(wèi)200萬劑。技(jì )術轉移後,MarocVax将繼續采購(gòu)至少等同于200萬劑的疫苗原液。
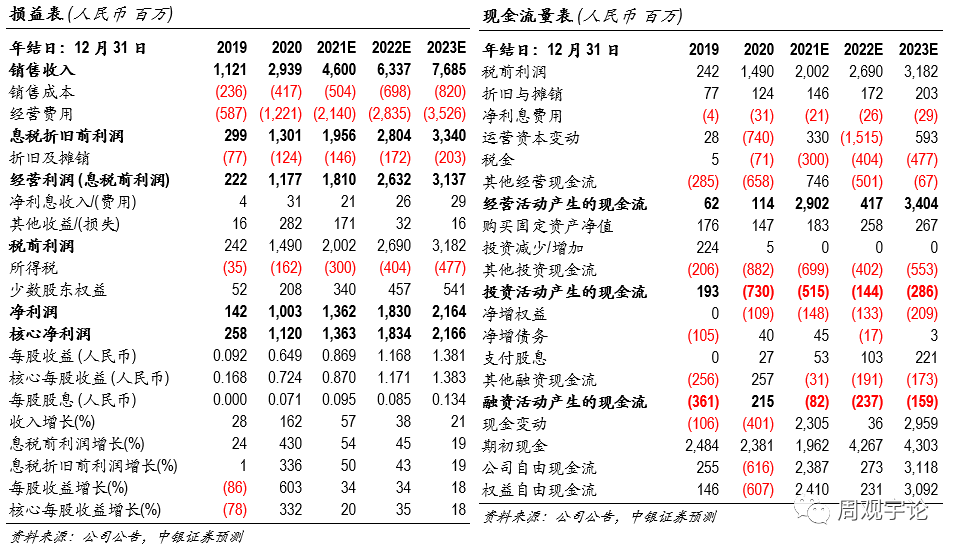
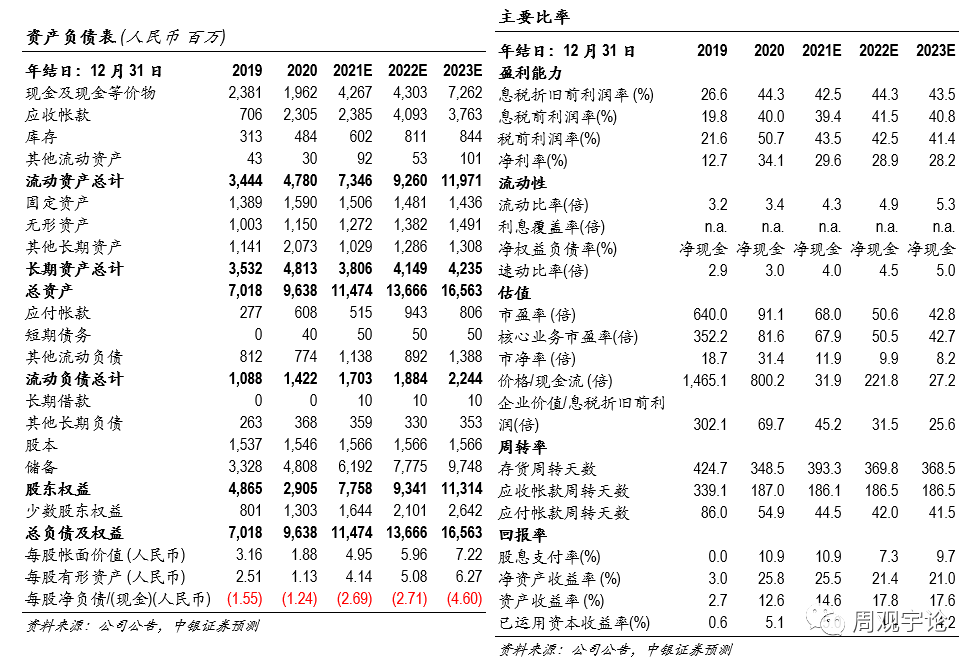
估值我們預測2021-2023年公(gōng)司可(kě)實現淨利潤13.62億元、18.30億元、21.64億元,對應EPS 0.87元、1.17元、1.38元。
評級面臨的主要風險研發進展不及預期;上市審批速度不及預期;銷售不及預期。
 公(gōng)司業績簡介
公(gōng)司業績簡介沃森生物(wù)成立于2001年,公(gōng)司長(cháng)期在疫苗領域深耕,擁有(yǒu)豐富且領先的産(chǎn)品管線(xiàn),包括13價肺炎結合疫苗和HPV疫苗。公(gōng)司2020年實現營業收入29.39億元,同比增長(cháng)162.13%;歸母淨利潤10.03億元,同比增長(cháng)606.60%。2021年第一季度實現營業收入4.34億元,同比增長(cháng)286.45%;歸母淨利潤3215.88萬元,同比增長(cháng)277.50%。2021年第一季度,公(gōng)司子公(gōng)司玉溪沃森獲批簽發産(chǎn)品數量合計9,749,407劑,同比下滑10.14%。除百白破疫苗批簽發量出現較明顯下滑外,其餘品種均實現了顯著的同比增長(cháng),其中(zhōng)13價肺炎結合疫苗開始放量,同比增長(cháng)1064.50%。
 公(gōng)司研發管線(xiàn)
公(gōng)司研發管線(xiàn)根據公(gōng)司2021年一季報,目前共有(yǒu)6條研發管線(xiàn),其中(zhōng)1項進入申報生産(chǎn)階段,其餘5項處于臨床研究階段。其中(zhōng)2價HPV疫苗、9價HPV疫苗、mRNA新(xīn)冠疫苗受到市場極高的關注。
 攜手艾博生物(wù)打造第一款國(guó)産(chǎn)mRNA疫苗。
攜手艾博生物(wù)打造第一款國(guó)産(chǎn)mRNA疫苗。5月11日,公(gōng)司公(gōng)告與蘇州艾博生物(wù)簽署合作(zuò)協議,緻力于開展新(xīn)冠mRNA疫苗的臨床前、臨床研究并實施商(shāng)業化生産(chǎn)。蘇州艾博生物(wù)具(jù)有(yǒu)mRNA疫苗設計的核心技(jì )術,其CEO英博先生曾供職于國(guó)際mRNA疫苗巨頭Moderna。沃森生物(wù)則擁有(yǒu)臨床注冊、研究、産(chǎn)業化和營銷方面的豐富經驗。公(gōng)司與艾博生物(wù)、軍事科(kē)學(xué)研究院共同研發的mRNA新(xīn)冠疫苗ARCoV是國(guó)内第一款獲批臨床的mRNA疫苗。目前,此款疫苗在國(guó)内進行臨床II期實驗。6月15日,在由BioBAY主辦(bàn)的核酸藥物(wù)研發論壇上,英博透露ARCoV正在啓動海外多(duō)中(zhōng)心III期臨床試驗,5月11日,墨西哥(gē)外交部長(cháng)埃布拉德(dé)宣布将在墨西哥(gē)開展此疫苗的III期臨床試驗,預計志(zhì)願者6000人,實驗将于5月31日開始。ARCoV新(xīn)冠mRNA疫苗的儲藏條件為(wèi)2-8攝氏度,相較于BNT162b2要求的-70攝氏度和mRNA1273的-20攝氏度更為(wèi)寬松。不過寬松的儲藏條件也相應地提高了對疫苗遞送系統要求,由于脂質(zhì)易在高溫條件下發生變質(zhì)、講解,因此需要密切關注ARCoV的有(yǒu)效期以及疫苗保護率是否會因此受到影響。
聚焦前沿技(jì )術,提前布局新(xīn)一代核酸類藥物(wù)4月27日,上市公(gōng)司與聖諾生物(wù)醫(yī)藥技(jì )術(蘇州)有(yǒu)限公(gōng)司(簡稱“聖諾生物(wù)”)、Sirnaomics,Inc.(聖諾制藥有(yǒu)限公(gōng)司,簡稱“美國(guó)聖諾”)簽署了抗病毒核酸幹擾藥物(wù)的合作(zuò)協議。聖諾生物(wù)負責完成藥物(wù)的臨床申報所需的臨床前研究,上市公(gōng)司則獲得該藥物(wù)在中(zhōng)國(guó)大陸及港澳台地區(qū)的獨家權利,包括臨床開發、注冊、生産(chǎn)制造和商(shāng)業化銷售的許可(kě)權。公(gōng)司将根據協議向聖諾生物(wù)支付500萬元預付款,3650萬元臨床前研發費用(yòng),以及藥物(wù)在不同臨床開發階段的裏程碑付款和産(chǎn)品銷售分(fēn)成。核酸幹擾(RNA interference,RNAi)類藥物(wù)是新(xīn)一代核酸藥物(wù),通過“沉默”靶基因或基因中(zhōng)的片段産(chǎn)生臨床效果,在治療腫瘤、免疫疾病、傳染疾病、以及神經退行性疾病中(zhōng)有(yǒu)廣闊的前景。RNAi中(zhōng)最重要的2種物(wù)質(zhì)分(fēn)别為(wèi)miRNA和siRNA。在DNA轉錄産(chǎn)生mRNA後,這兩種物(wù)質(zhì)能(néng)夠快速指引RNA分(fēn)解酶對生成的mRNA進行降解,阻止其進一步轉譯為(wèi)能(néng)夠對生物(wù)活動産(chǎn)生影響的蛋白質(zhì),以此變相沉默特定的基因片段。美國(guó)FDA于2018年和2019年11月相繼批準了Alnylam兩款RNAi藥物(wù)的上市申請,适應症分(fēn)别為(wèi)急性肝卟啉症、遺傳性轉甲狀腺素蛋白澱粉樣變性引起的基因紊亂。聖諾生物(wù)本次與沃森生物(wù)的合作(zuò)項目為(wèi)抗流感病毒的小(xiǎo)幹擾核酸藥物(wù)STP702。STP702預定的給藥途徑為(wèi)霧化吸入,目前該項目在中(zhōng)美均處于IND準備階段。
13價肺炎疫苗開始貢獻收入,國(guó)際化銷售錦上添花(huā)。2021年第一季度,控股子公(gōng)司玉溪沃森的13價肺炎疫苗獲批簽發164.3萬瓶,以達到2020年全年批簽發量的36.8%。同時,子公(gōng)司與摩洛哥(gē)MarocVax達成排他(tā)性協議。雙方将先開展成品供應合作(zuò),同時進行部分(fēn)技(jì )術轉移。MarocVax保證在收到完整産(chǎn)品注冊檔案後18個月内獲得上市許可(kě)。2021年,此疫苗于摩洛哥(gē)的銷量約為(wèi)200萬劑。技(jì )術轉移後,MarocVax将繼續采購(gòu)至少等同于200萬劑的疫苗原液。我們預測公(gōng)司的13價肺炎疫苗将在2021年繼續放量,并成為(wèi)公(gōng)司的主要營收來源。
風險提示研發不及預期:mRNA疫苗的序列設計和遞送系統為(wèi)前沿技(jì )術,可(kě)供參考的成功範例少,研發工(gōng)作(zuò)極其依賴公(gōng)司研發團隊的能(néng)力。因此,有(yǒu)研發不及預期的可(kě)能(néng)性。
上市審批速度不及預期:上市及審批受政策和疫情影響。若疫情控制較好,病毒變異并未造成現有(yǒu)疫苗明顯的免疫逃逸,則審批速度有(yǒu)可(kě)能(néng)放緩。
銷售不及預期:産(chǎn)品放量依賴市場需求,無論是對于新(xīn)冠疫苗還是公(gōng)司其他(tā)産(chǎn)品,需求的波動都有(yǒu)可(kě)能(néng)造成銷售的起伏。同時,競品或替代品的出現也有(yǒu)可(kě)能(néng)對銷售造成沖擊。
複星醫(yī)藥
全面布局創新(xīn),有(yǒu)望獲國(guó)内mRNA疫苗第一簽支撐評級的要點加速推進複必泰mRNA疫苗國(guó)内落地。5月9日,公(gōng)司公(gōng)告子公(gōng)司複星醫(yī)藥産(chǎn)業與BioNTech設立合資公(gōng)司,以實現mRNA新(xīn)冠疫苗産(chǎn)品的本地化生産(chǎn)及商(shāng)業化。雙方分(fēn)别認繳合資公(gōng)司注冊資本的50%,BioNTech以技(jì )術和許可(kě)等無形資産(chǎn)方式出資。複星醫(yī)藥産(chǎn)業應提供産(chǎn)能(néng)可(kě)達10億劑的生産(chǎn)設施。2021年1月,疫苗國(guó)内II期臨床試驗已完成所有(yǒu)受試者第二針的接種。在病毒變異以及疫苗有(yǒu)效期的雙重推動下,新(xīn)冠疫苗有(yǒu)望迎來第二輪需求。
國(guó)内首款CAR-T産(chǎn)品上市,為(wèi)淋巴瘤患者帶來新(xīn)曙光。2021年6月23日,NMPA批準了複星凱特的奕凱達的上市申請,用(yòng)于治療複發難治性大B細胞淋巴瘤。複興凱特在針對中(zhōng)國(guó)患者的難治性侵襲性大B細胞淋巴瘤的實驗中(zhōng)ORR達到79.2%,與Yescarta的臨床和真實世界數據高度相似。2020年Yescarta全球銷售額約6.07億美元,同比增長(cháng)33%。
公(gōng)司布局多(duō)條創新(xīn)藥研發管線(xiàn),為(wèi)長(cháng)期發展做好戰略儲備。公(gōng)司在創新(xīn)藥方面持續投入,研發費用(yòng)率穩定在10%左右,逐步接近國(guó)際制藥巨頭水平。阿達木(mù)單抗、曲妥珠單抗、CAR-T細胞治療等多(duō)個産(chǎn)品已獲批上市,成為(wèi)公(gōng)司營收新(xīn)的增長(cháng)點。截至2020年末,公(gōng)司在研創新(xīn)藥項目達56項,為(wèi)未來長(cháng)期發展做好戰略儲備。
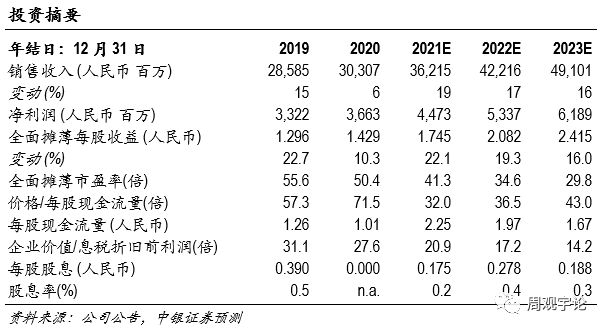
估值我們預測2021-2023年公(gōng)司可(kě)實現淨利潤44.73億元、53.37億元、61.89億元,對應EPS 1.75元、2.08元、2.41元。
評級面臨的主要風險研發不及預期,監管審批速度不及預期,疫情惡化風險。
 公(gōng)司業績簡介
公(gōng)司業績簡介複星醫(yī)藥廣泛布局醫(yī)藥健康産(chǎn)業鏈,直接運營業務(wù)闆塊包括制藥、醫(yī)療器械和診斷、醫(yī)療服務(wù),并通過參股國(guó)藥控股介入醫(yī)藥商(shāng)業領域。2020年,複星醫(yī)藥實現營業收入303.07億元,同比增長(cháng)6.02%;歸母淨利潤36.63億元,同比增長(cháng)10.27%。2021年第一季度,公(gōng)司實現營業收入80.56億元,同比增長(cháng)37.00%;歸母淨利潤8.47億元,同比增長(cháng)46.78%。
加速推進複必泰mRNA疫苗國(guó)内落地。5月9日,公(gōng)司公(gōng)告子公(gōng)司複星醫(yī)藥産(chǎn)業與BioNTech設立合資公(gōng)司,以實現mRNA新(xīn)冠疫苗産(chǎn)品的本地化生産(chǎn)及商(shāng)業化。雙方分(fēn)别認繳合資公(gōng)司注冊資本的50%,BioNTech以技(jì )術和許可(kě)等無形資産(chǎn)方式出資。複星醫(yī)藥産(chǎn)業應提供産(chǎn)能(néng)可(kě)達10億劑的生産(chǎn)設施。根據《供貨協議》,如以新(xīn)冠疫苗成品供貨,複星醫(yī)藥産(chǎn)業與BioNTech按65%、35%的比例分(fēn)享年度銷售毛利;如以大包裝(zhuāng)制劑供貨,複星醫(yī)藥産(chǎn)業(或其關聯公(gōng)司)、BioNTech按60%、40%的比例分(fēn)享年度銷售毛利。BNT162b2 mRNA新(xīn)冠疫苗在大中(zhōng)華區(qū)的商(shāng)品名(míng)為(wèi)複必泰。2021年1月,疫苗國(guó)内II期臨床試驗已完成所有(yǒu)受試者第二針的接種。在病毒變異以及疫苗有(yǒu)效期的雙重推動下,新(xīn)冠疫苗有(yǒu)望迎來第二輪需求。截至2021年6月30日,香港共已接種2,154,082劑複必泰疫苗。根據2020年12月11日香港政府發布的采購(gòu)公(gōng)告,香港政府計劃采購(gòu)750萬劑複必泰。複星醫(yī)藥2021年第一季度報告顯示公(gōng)司經營活動産(chǎn)生的現金流量淨額達到約7.37億元,同比增加92.62%,主要原因之一為(wèi)收到中(zhōng)國(guó)香港及中(zhōng)國(guó)澳門政府mRNA新(xīn)冠疫苗首付款以及支付相關采購(gòu)支出與研發銷售費用(yòng)後的淨貢獻。
國(guó)内首款CAR-T産(chǎn)品上市,為(wèi)淋巴瘤患者帶來新(xīn)曙光。2021年6月23日,複星凱特阿基倫賽注射液(商(shāng)品名(míng):奕凱達)獲NMPA批準上市,成為(wèi)了國(guó)内第一款獲批的CAR-T細胞産(chǎn)品。奕凱達由吉利德(dé)科(kē)學(xué)控股子公(gōng)司Kite Pharma的Yescarta技(jì )術轉移而來,國(guó)内獲批适應症為(wèi)二線(xiàn)及以上治療後複發或難治性大B細胞淋巴瘤。複興凱特在針對中(zhōng)國(guó)患者的難治性侵襲性大B細胞淋巴瘤的實驗中(zhōng)ORR達到79.2%,其中(zhōng)完全緩解率(CR)達到51%,部分(fēn)緩解率(PR)達到21%。與Yescarta的臨床和真實世界數據高度相似。2020年Yescarta全球銷售額約6.07億美元,同比增長(cháng)33%。2021年第一季度,Yescarta銷售額進一步上升至1.6億美元。
公(gōng)司前期研發投入進入收獲期,新(xīn)品成為(wèi)營收增量主要動力。阿達木(mù)單抗、曲妥珠單抗、CAR-T細胞治療等多(duō)個産(chǎn)品已獲批上市,成為(wèi)公(gōng)司營收新(xīn)的增長(cháng)點。其中(zhōng)漢利康(利妥昔單抗注射液)于2019年獲批上市,用(yòng)于治療非霍奇金淋巴瘤,并新(xīn)獲批适應症初治濾泡性淋巴瘤以及先前未經治療或複發性/難治性慢性淋巴細胞白血病。2020年全年創造銷售收入7.5億元,已成為(wèi)公(gōng)司銷售額最大的幾個品種之一。漢曲優(注射用(yòng)曲妥珠單抗)于2020年8月在國(guó)内獲批上市,用(yòng)于治療HER2陽性的轉移性乳腺癌、HER2陽性的早期乳腺癌、HER2陽性的轉移性胃腺癌或胃食管交界處腺癌。2020年7月,漢曲優獲歐盟委員會(EC)批準上市。2020年全年貢獻銷售收入1.4億元。蘇可(kě)欣(馬來酸阿伐曲泊帕片)于2020年8月開始上市銷售,用(yòng)于治療慢性肝病相關的血小(xiǎo)闆減少症。2020年實現銷售收入1.4億元,并于年底納入國(guó)家醫(yī)保目錄。
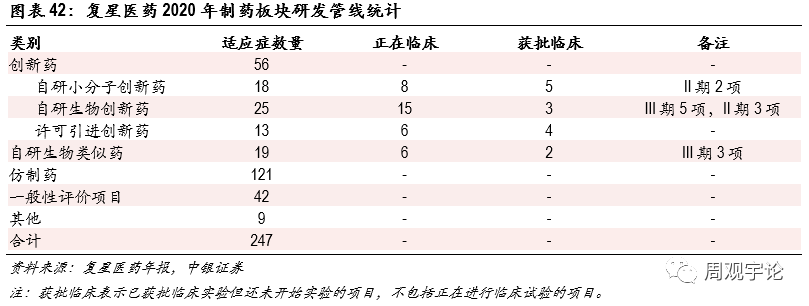
公(gōng)司布局多(duō)條創新(xīn)藥研發管線(xiàn),為(wèi)長(cháng)期發展做好戰略儲備。公(gōng)司在創新(xīn)藥方面持續投入,研發費用(yòng)率穩定在10%左右,逐步接近國(guó)際制藥巨頭水平。公(gōng)司2020年研發投入40.03億元,研發費用(yòng)27.95億元。截至2020年末,公(gōng)司在研創新(xīn)藥項目達56項,其中(zhōng)自研小(xiǎo)分(fēn)子創新(xīn)藥18項(臨床階段8項),自研生物(wù)創新(xīn)藥25項(臨床階段15項),許可(kě)引進創新(xīn)藥13項(臨床階段6項)。為(wèi)未來長(cháng)期發展做好戰略儲備。
 風險提示研發不及預期
風險提示研發不及預期:公(gōng)司參與大量創新(xīn)藥的研發。因此,有(yǒu)研發不及預期的可(kě)能(néng)性。
監管審批速度不及預期:上市及審批受政策和疫情影響。若疫情控制較好,病毒變異并未造成現有(yǒu)疫苗明顯的免疫逃逸,則審批速度有(yǒu)可(kě)能(néng)放緩。
疫情惡化風險:若疫情持續惡化,病毒變異速度加快,則有(yǒu)可(kě)能(néng)造成疫苗有(yǒu)效率的下降。同時也對公(gōng)司其他(tā)産(chǎn)品的銷售造成影響。
----------THE END----------
免責聲明:本文(wén)系轉載分(fēn)享,文(wén)章觀點、内容、圖片及版權歸原作(zuò)者所有(yǒu),如涉及侵權請聯系删除!

 細胞主導免疫的核心細胞是T細胞(T cell)。T細胞分(fēn)為(wèi)2類:輔助T細胞(CD4+)和殺手T細胞(CD8+)。當外源性蛋白質(zhì)進入體(tǐ)内,部分(fēn)蛋白會被抗原呈遞細胞(Antigen Presenbting Cell,APC)捕捉。常見的APC包括樹突細胞(DendriticCell,DC)、B細胞等。APC通過TLR(Toll-Like Receptor)分(fēn)辨是否是外來抗原。若識别結果為(wèi)外來抗原,APC會将抗原片段以抗原-MHC結合體(tǐ)的形式暴露在APC細胞膜表面。當輔助T細胞的受體(tǐ)(TCR)與MHC-抗原結合時,輔助T細胞會開始複制并釋放細胞素,激活B細胞和殺手T細胞。殺手T細胞被激活後通過MHC結構與APC結合,并釋放穿孔素和顆粒酶。穿孔素會附着在目标細胞膜上形成穿孔,顆粒酶通過穿孔進入細胞内部溶解細胞。當病原體(tǐ)消滅後,部分(fēn)CD4+和CD8+T細胞會繼續留在體(tǐ)内,稱為(wèi)記憶T細胞。與記憶B細胞類似,記憶T細胞擁有(yǒu)對抗原的特異性。若未來遭遇相同的外來抗原,T細胞能(néng)夠迅速擴增激活,殺滅入侵的病原體(tǐ)。總體(tǐ)而言,獲得性免疫的激發來源于對抗原的識别。當某一病原體(tǐ)首次入侵時時,由于沒有(yǒu)現成的特異化B細胞和T細胞,獲得性免疫的應答(dá)時間較長(cháng)。原始B細胞和T細胞需要時間分(fēn)化形成特異性免疫細胞。在完成首次殺滅後,部分(fēn)特異化的B細胞和T細胞會留存于體(tǐ)内成為(wèi)記憶B細胞、記憶T細胞。若未來再次遭遇相同抗原入侵,無需原始B/T細胞重新(xīn)分(fēn)化,記憶B細胞和T細胞将自我擴增、激活,迅速啓動免疫應答(dá)。
細胞主導免疫的核心細胞是T細胞(T cell)。T細胞分(fēn)為(wèi)2類:輔助T細胞(CD4+)和殺手T細胞(CD8+)。當外源性蛋白質(zhì)進入體(tǐ)内,部分(fēn)蛋白會被抗原呈遞細胞(Antigen Presenbting Cell,APC)捕捉。常見的APC包括樹突細胞(DendriticCell,DC)、B細胞等。APC通過TLR(Toll-Like Receptor)分(fēn)辨是否是外來抗原。若識别結果為(wèi)外來抗原,APC會将抗原片段以抗原-MHC結合體(tǐ)的形式暴露在APC細胞膜表面。當輔助T細胞的受體(tǐ)(TCR)與MHC-抗原結合時,輔助T細胞會開始複制并釋放細胞素,激活B細胞和殺手T細胞。殺手T細胞被激活後通過MHC結構與APC結合,并釋放穿孔素和顆粒酶。穿孔素會附着在目标細胞膜上形成穿孔,顆粒酶通過穿孔進入細胞内部溶解細胞。當病原體(tǐ)消滅後,部分(fēn)CD4+和CD8+T細胞會繼續留在體(tǐ)内,稱為(wèi)記憶T細胞。與記憶B細胞類似,記憶T細胞擁有(yǒu)對抗原的特異性。若未來遭遇相同的外來抗原,T細胞能(néng)夠迅速擴增激活,殺滅入侵的病原體(tǐ)。總體(tǐ)而言,獲得性免疫的激發來源于對抗原的識别。當某一病原體(tǐ)首次入侵時時,由于沒有(yǒu)現成的特異化B細胞和T細胞,獲得性免疫的應答(dá)時間較長(cháng)。原始B細胞和T細胞需要時間分(fēn)化形成特異性免疫細胞。在完成首次殺滅後,部分(fēn)特異化的B細胞和T細胞會留存于體(tǐ)内成為(wèi)記憶B細胞、記憶T細胞。若未來再次遭遇相同抗原入侵,無需原始B/T細胞重新(xīn)分(fēn)化,記憶B細胞和T細胞将自我擴增、激活,迅速啓動免疫應答(dá)。

 此轉譯為(wèi)肽鏈,最終折疊成為(wèi)蛋白質(zhì)。對于mRNA疫苗和藥物(wù),遞送系統有(yǒu)兩大職責:一是有(yǒu)效包裹和保護mRNA在到達靶點前維持穩定,二是幫助mRNA有(yǒu)效成分(fēn)進入細胞,三是在mRNA到達溶酶體(tǐ)前将其釋放進入細胞質(zhì)中(zhōng)。LNP是目前最具(jù)潛力的遞送載體(tǐ)之一。LNP(Lipid Nanoparticle)是脂質(zhì)微粒的總稱,其中(zhōng)又(yòu)包括脂質(zhì)膠團(micelle)、脂質(zhì)體(tǐ)(liposome)等。LNP與細胞膜的組成成分(fēn)相似,均由脂質(zhì)分(fēn)子構成。脂質(zhì)分(fēn)子的兩條長(cháng)尾通常呈平行狀态,在此狀态下,脂質(zhì)形成的雙分(fēn)子層穩定。在進入細胞質(zhì)酸性環境後,部分(fēn)脂質(zhì)的頭部質(zhì)子化,呈現陽離子形态,與其他(tā)陰性離子态的脂質(zhì)分(fēn)子相吸引,尾部張開。原本雙分(fēn)子層的形式被破壞,形成頭部聚集在一起的環狀。之前包裹在内的mRNA便可(kě)逃逸出内含體(tǐ),進入細胞質(zhì)等待轉譯。
此轉譯為(wèi)肽鏈,最終折疊成為(wèi)蛋白質(zhì)。對于mRNA疫苗和藥物(wù),遞送系統有(yǒu)兩大職責:一是有(yǒu)效包裹和保護mRNA在到達靶點前維持穩定,二是幫助mRNA有(yǒu)效成分(fēn)進入細胞,三是在mRNA到達溶酶體(tǐ)前将其釋放進入細胞質(zhì)中(zhōng)。LNP是目前最具(jù)潛力的遞送載體(tǐ)之一。LNP(Lipid Nanoparticle)是脂質(zhì)微粒的總稱,其中(zhōng)又(yòu)包括脂質(zhì)膠團(micelle)、脂質(zhì)體(tǐ)(liposome)等。LNP與細胞膜的組成成分(fēn)相似,均由脂質(zhì)分(fēn)子構成。脂質(zhì)分(fēn)子的兩條長(cháng)尾通常呈平行狀态,在此狀态下,脂質(zhì)形成的雙分(fēn)子層穩定。在進入細胞質(zhì)酸性環境後,部分(fēn)脂質(zhì)的頭部質(zhì)子化,呈現陽離子形态,與其他(tā)陰性離子态的脂質(zhì)分(fēn)子相吸引,尾部張開。原本雙分(fēn)子層的形式被破壞,形成頭部聚集在一起的環狀。之前包裹在内的mRNA便可(kě)逃逸出内含體(tǐ),進入細胞質(zhì)等待轉譯。 為(wèi)了提高載體(tǐ)對包裹成分(fēn)的保護能(néng)力,通過在載體(tǐ)外部連接PEG可(kě)以進一步增強載體(tǐ)的穩定性。
為(wèi)了提高載體(tǐ)對包裹成分(fēn)的保護能(néng)力,通過在載體(tǐ)外部連接PEG可(kě)以進一步增強載體(tǐ)的穩定性。 根據年齡段劃分(fēn),BNT162b2對16-64歲人群的保護率為(wèi)95.1%,對65歲及以上的老年群體(tǐ)保護率則維持在了94.7%。數據顯示了mRNA疫苗在人群中(zhōng)激活免疫系統的能(néng)力基本不受接種者年齡的影響。
根據年齡段劃分(fēn),BNT162b2對16-64歲人群的保護率為(wèi)95.1%,對65歲及以上的老年群體(tǐ)保護率則維持在了94.7%。數據顯示了mRNA疫苗在人群中(zhōng)激活免疫系統的能(néng)力基本不受接種者年齡的影響。 本次臨床試驗的樣本人群中(zhōng)包含了65歲及以上的老年人群,疫苗組中(zhōng)有(yǒu)3583位老年人,其中(zhōng)出現4例新(xīn)冠感染;安(ān)慰劑組中(zhōng)有(yǒu)3552位老年人,其中(zhōng)出現29例新(xīn)冠感染。因此,mRNA-1273對于65歲及以上的人群的有(yǒu)效保護率為(wèi)86.4%,表現仍舊非常優秀。
本次臨床試驗的樣本人群中(zhōng)包含了65歲及以上的老年人群,疫苗組中(zhōng)有(yǒu)3583位老年人,其中(zhōng)出現4例新(xīn)冠感染;安(ān)慰劑組中(zhōng)有(yǒu)3552位老年人,其中(zhōng)出現29例新(xīn)冠感染。因此,mRNA-1273對于65歲及以上的人群的有(yǒu)效保護率為(wèi)86.4%,表現仍舊非常優秀。


 56歲及以上人群接種疫苗後不良反應的發生頻率并未顯示出疫苗會對老年群體(tǐ)造成更嚴重的副作(zuò)用(yòng),老年人群報告的不良反應發生頻率甚至略低于18-55歲年齡段的水平。不同種類的不良反應發生規律與18-55歲年齡層類似,頭疼和疲憊的發生頻率較高。
56歲及以上人群接種疫苗後不良反應的發生頻率并未顯示出疫苗會對老年群體(tǐ)造成更嚴重的副作(zuò)用(yòng),老年人群報告的不良反應發生頻率甚至略低于18-55歲年齡段的水平。不同種類的不良反應發生規律與18-55歲年齡層類似,頭疼和疲憊的發生頻率較高。 12-15歲年齡層人群接種疫苗後不良反應的發生規律與其他(tā)兩個年齡層相似,不良反應發生概率略高于其他(tā)兩個年齡層。12-15歲年齡層人群接種疫苗後出現發熱的概率較高。接種第一劑後的發熱概率為(wèi)10.1%(對應安(ān)慰劑組1.1%),接種第二劑後的發熱概率為(wèi)19.6%(對應安(ān)慰劑組0.6%)。
12-15歲年齡層人群接種疫苗後不良反應的發生規律與其他(tā)兩個年齡層相似,不良反應發生概率略高于其他(tā)兩個年齡層。12-15歲年齡層人群接種疫苗後出現發熱的概率較高。接種第一劑後的發熱概率為(wèi)10.1%(對應安(ān)慰劑組1.1%),接種第二劑後的發熱概率為(wèi)19.6%(對應安(ān)慰劑組0.6%)。 根據CDC數據,截至2021年1月18日,接種BNT162b2疫苗後引起的過敏反應在每百萬人中(zhōng)僅出現5例,概率極低。
根據CDC數據,截至2021年1月18日,接種BNT162b2疫苗後引起的過敏反應在每百萬人中(zhōng)僅出現5例,概率極低。 65歲及以上人群接種疫苗後不良反應的發生規律與18-64歲年齡層類似,局部不良反應中(zhōng)疼痛的出現頻率較高,第一次和第二次注射後出現概率分(fēn)别為(wèi)74.0%、83.2%(對應安(ān)慰劑組12.8%、12.0%)。系統性反應中(zhōng),頭疼和疲憊的發生頻率較高。第二劑接種後,發熱、發冷、肌肉關節疼痛等不良反應出現概率較第一劑接種後數據上升較為(wèi)明顯。
65歲及以上人群接種疫苗後不良反應的發生規律與18-64歲年齡層類似,局部不良反應中(zhōng)疼痛的出現頻率較高,第一次和第二次注射後出現概率分(fēn)别為(wèi)74.0%、83.2%(對應安(ān)慰劑組12.8%、12.0%)。系統性反應中(zhōng),頭疼和疲憊的發生頻率較高。第二劑接種後,發熱、發冷、肌肉關節疼痛等不良反應出現概率較第一劑接種後數據上升較為(wèi)明顯。 2款mRNA疫苗的III期臨床試驗不良反應數據方面接近,局部反應中(zhōng)疼痛最為(wèi)普遍,在主要人群中(zhōng)第一劑次和第二劑次平均出現概率為(wèi)82.4%、85.0%(對應安(ān)慰劑組16.3%、15.6%)。系統性不良反應中(zhōng)疲憊與頭痛出現比例較高,在18歲及以上人群接種第二劑次後,疲憊與頭痛的報告比例分(fēn)别為(wèi),三級及以上疲憊的出現概率平均為(wèi)7.68%(對應安(ān)慰劑組0.67%),三級及以上頭痛的出現概率為(wèi)3.99%(對應安(ān)慰劑組0.99%)。
2款mRNA疫苗的III期臨床試驗不良反應數據方面接近,局部反應中(zhōng)疼痛最為(wèi)普遍,在主要人群中(zhōng)第一劑次和第二劑次平均出現概率為(wèi)82.4%、85.0%(對應安(ān)慰劑組16.3%、15.6%)。系統性不良反應中(zhōng)疲憊與頭痛出現比例較高,在18歲及以上人群接種第二劑次後,疲憊與頭痛的報告比例分(fēn)别為(wèi),三級及以上疲憊的出現概率平均為(wèi)7.68%(對應安(ān)慰劑組0.67%),三級及以上頭痛的出現概率為(wèi)3.99%(對應安(ān)慰劑組0.99%)。 從不良反應發生比例來看,滅活疫苗接種後短期内各項不良反應發生比例明顯低于mRNA疫苗。雖然三款疫苗臨床試驗對于不良反應的定義不同,對照組不同,數據收集周期有(yǒu)差别,但數據上巨大的差異仍能(néng)或多(duō)或少地體(tǐ)現出mRNA疫苗會帶來較多(duō)較強烈的不适。發熱,作(zuò)為(wèi)能(néng)夠進行橫向量化對比的不良反應之一,在接種mRNA疫苗後出現頻率遠(yuǎn)遠(yuǎn)高于接種滅活疫苗後的頻率。接種滅活疫苗後發熱(38.0°C以上)的發生比例平均為(wèi)0.4%,38.5°C以上的發生比例為(wèi)0.2%;接種mRNA疫苗後發熱(38.0°C以上)的平均發生比例為(wèi)17.1%,39°C及以上的平均發生比例為(wèi)1.7%,均高于滅活疫苗的對應數據。
從不良反應發生比例來看,滅活疫苗接種後短期内各項不良反應發生比例明顯低于mRNA疫苗。雖然三款疫苗臨床試驗對于不良反應的定義不同,對照組不同,數據收集周期有(yǒu)差别,但數據上巨大的差異仍能(néng)或多(duō)或少地體(tǐ)現出mRNA疫苗會帶來較多(duō)較強烈的不适。發熱,作(zuò)為(wèi)能(néng)夠進行橫向量化對比的不良反應之一,在接種mRNA疫苗後出現頻率遠(yuǎn)遠(yuǎn)高于接種滅活疫苗後的頻率。接種滅活疫苗後發熱(38.0°C以上)的發生比例平均為(wèi)0.4%,38.5°C以上的發生比例為(wèi)0.2%;接種mRNA疫苗後發熱(38.0°C以上)的平均發生比例為(wèi)17.1%,39°C及以上的平均發生比例為(wèi)1.7%,均高于滅活疫苗的對應數據。
 mRNA疫苗對新(xīn)冠病毒的保護率高達94%以上,國(guó)藥傳統滅活疫苗的保護率雖遠(yuǎn)遠(yuǎn)高于WHO和FDA建議标準的50%,但不足80%,與mRNA疫苗差距明顯。
mRNA疫苗對新(xīn)冠病毒的保護率高達94%以上,國(guó)藥傳統滅活疫苗的保護率雖遠(yuǎn)遠(yuǎn)高于WHO和FDA建議标準的50%,但不足80%,與mRNA疫苗差距明顯。 款mRNA疫苗均對64歲以上的老年人群展現了非常可(kě)觀的保護率。BioNTech的BNT162b2對64歲以上群體(tǐ)的保護率為(wèi)94.7%,僅比16-64歲群體(tǐ)數據低0.4%。Moderna的mRNA1273對64歲以上人群的保護率也高達86.4%,仍舊高于滅活疫苗的整體(tǐ)數據。
款mRNA疫苗均對64歲以上的老年人群展現了非常可(kě)觀的保護率。BioNTech的BNT162b2對64歲以上群體(tǐ)的保護率為(wèi)94.7%,僅比16-64歲群體(tǐ)數據低0.4%。Moderna的mRNA1273對64歲以上人群的保護率也高達86.4%,仍舊高于滅活疫苗的整體(tǐ)數據。

 短期内,國(guó)内新(xīn)冠疫苗市場已被傳統的滅活疫苗占據。截至2021年6月4日,國(guó)内疫苗接種劑次已達7億劑次。18-59歲年齡層為(wèi)新(xīn)冠疫苗适齡人群,以2020年第七次全國(guó)人口普查數據為(wèi)标準,我國(guó)15-59歲人口約8.94億人。大部分(fēn)适齡人群已接受第一劑注射。大部分(fēn)疫苗需要多(duō)次接種完成完整的免疫過程,在此過程中(zhōng),接種同一廠家或技(jì )術路徑的疫苗能(néng)夠較為(wèi)穩妥地實現免疫激活的既定目标。目前沒有(yǒu)已完成的臨床試驗可(kě)以證實接種不同技(jì )術路徑的疫苗的安(ān)全性,或是能(néng)夠達到預定的免疫效果。因此,後續疫苗很(hěn)大可(kě)能(néng)仍會按照同一廠家同一路徑完成接種,短期内mRNA新(xīn)冠疫苗在國(guó)内市場的空間有(yǒu)限。雖然國(guó)内市場已較為(wèi)飽和,但與此同時,海外疫情持續發酵。2021年3月,全球新(xīn)增新(xīn)冠确診人數1404萬例,4月新(xīn)增2319萬例,累計确診人數也一路飙升。
短期内,國(guó)内新(xīn)冠疫苗市場已被傳統的滅活疫苗占據。截至2021年6月4日,國(guó)内疫苗接種劑次已達7億劑次。18-59歲年齡層為(wèi)新(xīn)冠疫苗适齡人群,以2020年第七次全國(guó)人口普查數據為(wèi)标準,我國(guó)15-59歲人口約8.94億人。大部分(fēn)适齡人群已接受第一劑注射。大部分(fēn)疫苗需要多(duō)次接種完成完整的免疫過程,在此過程中(zhōng),接種同一廠家或技(jì )術路徑的疫苗能(néng)夠較為(wèi)穩妥地實現免疫激活的既定目标。目前沒有(yǒu)已完成的臨床試驗可(kě)以證實接種不同技(jì )術路徑的疫苗的安(ān)全性,或是能(néng)夠達到預定的免疫效果。因此,後續疫苗很(hěn)大可(kě)能(néng)仍會按照同一廠家同一路徑完成接種,短期内mRNA新(xīn)冠疫苗在國(guó)内市場的空間有(yǒu)限。雖然國(guó)内市場已較為(wèi)飽和,但與此同時,海外疫情持續發酵。2021年3月,全球新(xīn)增新(xīn)冠确診人數1404萬例,4月新(xīn)增2319萬例,累計确診人數也一路飙升。 美國(guó)疫情控制已經證實了疫苗帶來的免疫屏障能(néng)夠有(yǒu)效降低新(xīn)增病例數,建立覆蓋全球的免疫屏障是世界經濟重回正常的必經之路。由于全球新(xīn)冠疫苗獲WHO緊急使用(yòng)的種類少,且産(chǎn)能(néng)有(yǒu)限,疫苗仍舊處于緊缺狀态,尤其是經濟科(kē)技(jì )相對落後的發展中(zhōng)國(guó)家。2021年5月,全球新(xīn)冠疫苗累計接種19.07億劑次,每百人中(zhōng)接種至少1劑次的約10.73人。根據世界銀行數據,2019年全球15-64歲人群占比65.252%,若不考慮患有(yǒu)基礎疾病無法接種的人群,則适齡人群中(zhōng)每百人未接種任何疫苗的人數為(wèi)54.522人。全球人口為(wèi)77.95億,則未接種任何新(xīn)冠疫苗的适齡人數約為(wèi)42.50億人,以每人2劑次折算,則理(lǐ)論空間為(wèi)85.00億劑次。全球疫苗産(chǎn)能(néng)緊張,擁有(yǒu)疫苗技(jì )術和生産(chǎn)能(néng)力的國(guó)家十分(fēn)有(yǒu)限,許多(duō)國(guó)家無法得到疫苗,尤其是經濟科(kē)技(jì )較為(wèi)落後的發展中(zhōng)國(guó)家。因此,新(xīn)冠疫苗的海外市場有(yǒu)非常巨大的發展空間。
美國(guó)疫情控制已經證實了疫苗帶來的免疫屏障能(néng)夠有(yǒu)效降低新(xīn)增病例數,建立覆蓋全球的免疫屏障是世界經濟重回正常的必經之路。由于全球新(xīn)冠疫苗獲WHO緊急使用(yòng)的種類少,且産(chǎn)能(néng)有(yǒu)限,疫苗仍舊處于緊缺狀态,尤其是經濟科(kē)技(jì )相對落後的發展中(zhōng)國(guó)家。2021年5月,全球新(xīn)冠疫苗累計接種19.07億劑次,每百人中(zhōng)接種至少1劑次的約10.73人。根據世界銀行數據,2019年全球15-64歲人群占比65.252%,若不考慮患有(yǒu)基礎疾病無法接種的人群,則适齡人群中(zhōng)每百人未接種任何疫苗的人數為(wèi)54.522人。全球人口為(wèi)77.95億,則未接種任何新(xīn)冠疫苗的适齡人數約為(wèi)42.50億人,以每人2劑次折算,則理(lǐ)論空間為(wèi)85.00億劑次。全球疫苗産(chǎn)能(néng)緊張,擁有(yǒu)疫苗技(jì )術和生産(chǎn)能(néng)力的國(guó)家十分(fēn)有(yǒu)限,許多(duō)國(guó)家無法得到疫苗,尤其是經濟科(kē)技(jì )較為(wèi)落後的發展中(zhōng)國(guó)家。因此,新(xīn)冠疫苗的海外市場有(yǒu)非常巨大的發展空間。 由于缺失大部分(fēn)數據,我們無法得知數據中(zhōng)有(yǒu)多(duō)少人已完成整套接種。僅有(yǒu)2021年6月10日當日數據提到截至當日完成整套接種流程的人數,約為(wèi)2.233億人。以2劑次為(wèi)标準,折算為(wèi)4.466億劑次,截至當日全國(guó)接種劑次總數為(wèi)8.45億劑次,用(yòng)于完成整套接種的劑次數占總接種劑次數的26.42%。按照6個月保護期計算,截至2021年12月10日左右将有(yǒu)2.233億人需要第二輪新(xīn)冠疫苗接種。根據2021年6月10日數據,截至當日接種了一劑次的人數為(wèi)3.984億人,這一部分(fēn)群體(tǐ)在2021年7月10日前将接種第二劑次,并且在2022年1月10日前開始進行第二輪的接種,屆時國(guó)内市場将有(yǒu)約4億劑次的新(xīn)需求。
由于缺失大部分(fēn)數據,我們無法得知數據中(zhōng)有(yǒu)多(duō)少人已完成整套接種。僅有(yǒu)2021年6月10日當日數據提到截至當日完成整套接種流程的人數,約為(wèi)2.233億人。以2劑次為(wèi)标準,折算為(wèi)4.466億劑次,截至當日全國(guó)接種劑次總數為(wèi)8.45億劑次,用(yòng)于完成整套接種的劑次數占總接種劑次數的26.42%。按照6個月保護期計算,截至2021年12月10日左右将有(yǒu)2.233億人需要第二輪新(xīn)冠疫苗接種。根據2021年6月10日數據,截至當日接種了一劑次的人數為(wèi)3.984億人,這一部分(fēn)群體(tǐ)在2021年7月10日前将接種第二劑次,并且在2022年1月10日前開始進行第二輪的接種,屆時國(guó)内市場将有(yǒu)約4億劑次的新(xīn)需求。




 mRNA序列是疫苗研發中(zhōng)的重點,也是行業内競争的核心。除了含有(yǒu)抗原蛋白編碼外,序列其他(tā)部分(fēn)也直接影響mRNA疫苗的質(zhì)量。編碼前後的非轉譯區(qū)(UTR)負責調控轉譯以及蛋白表達,對mRNA的轉譯效率、半衰期、最高表達水平等數值有(yǒu)影響。轉譯效率可(kě)用(yòng)來推斷相同單位mRNA疫苗産(chǎn)生抗原的速度、半衰期用(yòng)以推斷mRNA能(néng)夠産(chǎn)生抗原蛋白的時間、表達累計最高水平用(yòng)以推斷每單位mRNA在某一時刻能(néng)産(chǎn)生的抗原量的最高水平。同時,UTR中(zhōng)的GC水平、U水平均會影響mRNA的免疫原性,對疫苗的安(ān)全性和能(néng)否正常産(chǎn)生抗原造成影響。UTR需要在DNA質(zhì)粒建立時包含在序列中(zhōng),屬于序列設計的一部分(fēn)。3’端多(duō)聚A尾(poly-A tail;A指腺苷,4種基礎核苷酸的一種)位于mRNA尾部3’端,長(cháng)度約100-250單位。多(duō)聚A尾能(néng)夠提高mRNA的穩定性和轉譯效率。腺苷(A)能(néng)夠降低核糖核酸酶(RNases)的效率,以此減緩mRNA的降解速度。多(duō)聚A尾可(kě)在建立DNA質(zhì)粒時直接包含于編碼中(zhōng),也可(kě)在DNA轉錄為(wèi)mRNA後通過聚合酶(poly-A polymerase,PAP)添加于mRNA尾部。
mRNA序列是疫苗研發中(zhōng)的重點,也是行業内競争的核心。除了含有(yǒu)抗原蛋白編碼外,序列其他(tā)部分(fēn)也直接影響mRNA疫苗的質(zhì)量。編碼前後的非轉譯區(qū)(UTR)負責調控轉譯以及蛋白表達,對mRNA的轉譯效率、半衰期、最高表達水平等數值有(yǒu)影響。轉譯效率可(kě)用(yòng)來推斷相同單位mRNA疫苗産(chǎn)生抗原的速度、半衰期用(yòng)以推斷mRNA能(néng)夠産(chǎn)生抗原蛋白的時間、表達累計最高水平用(yòng)以推斷每單位mRNA在某一時刻能(néng)産(chǎn)生的抗原量的最高水平。同時,UTR中(zhōng)的GC水平、U水平均會影響mRNA的免疫原性,對疫苗的安(ān)全性和能(néng)否正常産(chǎn)生抗原造成影響。UTR需要在DNA質(zhì)粒建立時包含在序列中(zhōng),屬于序列設計的一部分(fēn)。3’端多(duō)聚A尾(poly-A tail;A指腺苷,4種基礎核苷酸的一種)位于mRNA尾部3’端,長(cháng)度約100-250單位。多(duō)聚A尾能(néng)夠提高mRNA的穩定性和轉譯效率。腺苷(A)能(néng)夠降低核糖核酸酶(RNases)的效率,以此減緩mRNA的降解速度。多(duō)聚A尾可(kě)在建立DNA質(zhì)粒時直接包含于編碼中(zhōng),也可(kě)在DNA轉錄為(wèi)mRNA後通過聚合酶(poly-A polymerase,PAP)添加于mRNA尾部。 同時,位于mRNA最前端的5’帽結構對于降低mRNA免疫原性,增強穩定性和翻譯效率有(yǒu)正面影響。5’帽結構是一個位于mRNA序列之前的反向7-甲基鳥苷(m7G)。在體(tǐ)外轉錄(IVT)過程中(zhōng),mRNA5’端會含有(yǒu)三磷酸鹽部分(fēn),具(jù)有(yǒu)很(hěn)強的免疫原性。若不去除這一部分(fēn),當mRNA被遞送進入人體(tǐ)細胞後,mRNA會在細胞質(zhì)中(zhōng)引起IFN-1免疫反應,無法在人體(tǐ)内正常轉譯産(chǎn)生蛋白抗原。加帽過程可(kě)在DNA轉錄為(wèi)mRNA的生産(chǎn)過程中(zhōng)或過程後進行,利用(yòng)抗反向帽類似物(wù)(ARCA)将5’帽結構按正确方向固定在mRNA的5’端。但是此過程不能(néng)保證三磷酸鹽完全被去除,所以仍舊存在引起細胞内免疫反應的風險,因此加帽工(gōng)藝對疫苗的安(ān)全性有(yǒu)直接影響。
同時,位于mRNA最前端的5’帽結構對于降低mRNA免疫原性,增強穩定性和翻譯效率有(yǒu)正面影響。5’帽結構是一個位于mRNA序列之前的反向7-甲基鳥苷(m7G)。在體(tǐ)外轉錄(IVT)過程中(zhōng),mRNA5’端會含有(yǒu)三磷酸鹽部分(fēn),具(jù)有(yǒu)很(hěn)強的免疫原性。若不去除這一部分(fēn),當mRNA被遞送進入人體(tǐ)細胞後,mRNA會在細胞質(zhì)中(zhōng)引起IFN-1免疫反應,無法在人體(tǐ)内正常轉譯産(chǎn)生蛋白抗原。加帽過程可(kě)在DNA轉錄為(wèi)mRNA的生産(chǎn)過程中(zhōng)或過程後進行,利用(yòng)抗反向帽類似物(wù)(ARCA)将5’帽結構按正确方向固定在mRNA的5’端。但是此過程不能(néng)保證三磷酸鹽完全被去除,所以仍舊存在引起細胞内免疫反應的風險,因此加帽工(gōng)藝對疫苗的安(ān)全性有(yǒu)直接影響。

 除Moderna外,另一大mRNA廠商(shāng)CureVac在2016年也從Acuitas獲得了LNP相關授權,目前暫未顯示CureVac被卷入相關的訴訟中(zhōng)。根據ipwatchdog的報道,2020年7月CureVac的SEC F-1登記表中(zhōng)表明此授權協議仍舊有(yǒu)效,因此CureVac與Acuitas的協議可(kě)能(néng)并不涉及來自Arbutus的再許可(kě)。
除Moderna外,另一大mRNA廠商(shāng)CureVac在2016年也從Acuitas獲得了LNP相關授權,目前暫未顯示CureVac被卷入相關的訴訟中(zhōng)。根據ipwatchdog的報道,2020年7月CureVac的SEC F-1登記表中(zhōng)表明此授權協議仍舊有(yǒu)效,因此CureVac與Acuitas的協議可(kě)能(néng)并不涉及來自Arbutus的再許可(kě)。





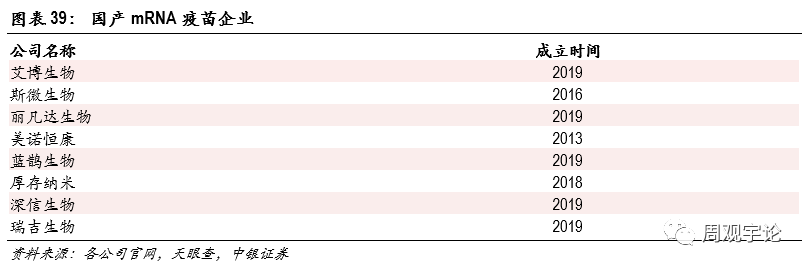 風險提示研發進展不及預期、銷售不及預期、監管政策收緊風險。
風險提示研發進展不及預期、銷售不及預期、監管政策收緊風險。
 公(gōng)司業績簡介沃森生物(wù)成立于2001年,公(gōng)司長(cháng)期在疫苗領域深耕,擁有(yǒu)豐富且領先的産(chǎn)品管線(xiàn),包括13價肺炎結合疫苗和HPV疫苗。公(gōng)司2020年實現營業收入29.39億元,同比增長(cháng)162.13%;歸母淨利潤10.03億元,同比增長(cháng)606.60%。2021年第一季度實現營業收入4.34億元,同比增長(cháng)286.45%;歸母淨利潤3215.88萬元,同比增長(cháng)277.50%。2021年第一季度,公(gōng)司子公(gōng)司玉溪沃森獲批簽發産(chǎn)品數量合計9,749,407劑,同比下滑10.14%。除百白破疫苗批簽發量出現較明顯下滑外,其餘品種均實現了顯著的同比增長(cháng),其中(zhōng)13價肺炎結合疫苗開始放量,同比增長(cháng)1064.50%。
公(gōng)司業績簡介沃森生物(wù)成立于2001年,公(gōng)司長(cháng)期在疫苗領域深耕,擁有(yǒu)豐富且領先的産(chǎn)品管線(xiàn),包括13價肺炎結合疫苗和HPV疫苗。公(gōng)司2020年實現營業收入29.39億元,同比增長(cháng)162.13%;歸母淨利潤10.03億元,同比增長(cháng)606.60%。2021年第一季度實現營業收入4.34億元,同比增長(cháng)286.45%;歸母淨利潤3215.88萬元,同比增長(cháng)277.50%。2021年第一季度,公(gōng)司子公(gōng)司玉溪沃森獲批簽發産(chǎn)品數量合計9,749,407劑,同比下滑10.14%。除百白破疫苗批簽發量出現較明顯下滑外,其餘品種均實現了顯著的同比增長(cháng),其中(zhōng)13價肺炎結合疫苗開始放量,同比增長(cháng)1064.50%。 公(gōng)司研發管線(xiàn)根據公(gōng)司2021年一季報,目前共有(yǒu)6條研發管線(xiàn),其中(zhōng)1項進入申報生産(chǎn)階段,其餘5項處于臨床研究階段。其中(zhōng)2價HPV疫苗、9價HPV疫苗、mRNA新(xīn)冠疫苗受到市場極高的關注。
公(gōng)司研發管線(xiàn)根據公(gōng)司2021年一季報,目前共有(yǒu)6條研發管線(xiàn),其中(zhōng)1項進入申報生産(chǎn)階段,其餘5項處于臨床研究階段。其中(zhōng)2價HPV疫苗、9價HPV疫苗、mRNA新(xīn)冠疫苗受到市場極高的關注。 攜手艾博生物(wù)打造第一款國(guó)産(chǎn)mRNA疫苗。5月11日,公(gōng)司公(gōng)告與蘇州艾博生物(wù)簽署合作(zuò)協議,緻力于開展新(xīn)冠mRNA疫苗的臨床前、臨床研究并實施商(shāng)業化生産(chǎn)。蘇州艾博生物(wù)具(jù)有(yǒu)mRNA疫苗設計的核心技(jì )術,其CEO英博先生曾供職于國(guó)際mRNA疫苗巨頭Moderna。沃森生物(wù)則擁有(yǒu)臨床注冊、研究、産(chǎn)業化和營銷方面的豐富經驗。公(gōng)司與艾博生物(wù)、軍事科(kē)學(xué)研究院共同研發的mRNA新(xīn)冠疫苗ARCoV是國(guó)内第一款獲批臨床的mRNA疫苗。目前,此款疫苗在國(guó)内進行臨床II期實驗。6月15日,在由BioBAY主辦(bàn)的核酸藥物(wù)研發論壇上,英博透露ARCoV正在啓動海外多(duō)中(zhōng)心III期臨床試驗,5月11日,墨西哥(gē)外交部長(cháng)埃布拉德(dé)宣布将在墨西哥(gē)開展此疫苗的III期臨床試驗,預計志(zhì)願者6000人,實驗将于5月31日開始。ARCoV新(xīn)冠mRNA疫苗的儲藏條件為(wèi)2-8攝氏度,相較于BNT162b2要求的-70攝氏度和mRNA1273的-20攝氏度更為(wèi)寬松。不過寬松的儲藏條件也相應地提高了對疫苗遞送系統要求,由于脂質(zhì)易在高溫條件下發生變質(zhì)、講解,因此需要密切關注ARCoV的有(yǒu)效期以及疫苗保護率是否會因此受到影響。聚焦前沿技(jì )術,提前布局新(xīn)一代核酸類藥物(wù)4月27日,上市公(gōng)司與聖諾生物(wù)醫(yī)藥技(jì )術(蘇州)有(yǒu)限公(gōng)司(簡稱“聖諾生物(wù)”)、Sirnaomics,Inc.(聖諾制藥有(yǒu)限公(gōng)司,簡稱“美國(guó)聖諾”)簽署了抗病毒核酸幹擾藥物(wù)的合作(zuò)協議。聖諾生物(wù)負責完成藥物(wù)的臨床申報所需的臨床前研究,上市公(gōng)司則獲得該藥物(wù)在中(zhōng)國(guó)大陸及港澳台地區(qū)的獨家權利,包括臨床開發、注冊、生産(chǎn)制造和商(shāng)業化銷售的許可(kě)權。公(gōng)司将根據協議向聖諾生物(wù)支付500萬元預付款,3650萬元臨床前研發費用(yòng),以及藥物(wù)在不同臨床開發階段的裏程碑付款和産(chǎn)品銷售分(fēn)成。核酸幹擾(RNA interference,RNAi)類藥物(wù)是新(xīn)一代核酸藥物(wù),通過“沉默”靶基因或基因中(zhōng)的片段産(chǎn)生臨床效果,在治療腫瘤、免疫疾病、傳染疾病、以及神經退行性疾病中(zhōng)有(yǒu)廣闊的前景。RNAi中(zhōng)最重要的2種物(wù)質(zhì)分(fēn)别為(wèi)miRNA和siRNA。在DNA轉錄産(chǎn)生mRNA後,這兩種物(wù)質(zhì)能(néng)夠快速指引RNA分(fēn)解酶對生成的mRNA進行降解,阻止其進一步轉譯為(wèi)能(néng)夠對生物(wù)活動産(chǎn)生影響的蛋白質(zhì),以此變相沉默特定的基因片段。美國(guó)FDA于2018年和2019年11月相繼批準了Alnylam兩款RNAi藥物(wù)的上市申請,适應症分(fēn)别為(wèi)急性肝卟啉症、遺傳性轉甲狀腺素蛋白澱粉樣變性引起的基因紊亂。聖諾生物(wù)本次與沃森生物(wù)的合作(zuò)項目為(wèi)抗流感病毒的小(xiǎo)幹擾核酸藥物(wù)STP702。STP702預定的給藥途徑為(wèi)霧化吸入,目前該項目在中(zhōng)美均處于IND準備階段。13價肺炎疫苗開始貢獻收入,國(guó)際化銷售錦上添花(huā)。2021年第一季度,控股子公(gōng)司玉溪沃森的13價肺炎疫苗獲批簽發164.3萬瓶,以達到2020年全年批簽發量的36.8%。同時,子公(gōng)司與摩洛哥(gē)MarocVax達成排他(tā)性協議。雙方将先開展成品供應合作(zuò),同時進行部分(fēn)技(jì )術轉移。MarocVax保證在收到完整産(chǎn)品注冊檔案後18個月内獲得上市許可(kě)。2021年,此疫苗于摩洛哥(gē)的銷量約為(wèi)200萬劑。技(jì )術轉移後,MarocVax将繼續采購(gòu)至少等同于200萬劑的疫苗原液。我們預測公(gōng)司的13價肺炎疫苗将在2021年繼續放量,并成為(wèi)公(gōng)司的主要營收來源。風險提示研發不及預期:mRNA疫苗的序列設計和遞送系統為(wèi)前沿技(jì )術,可(kě)供參考的成功範例少,研發工(gōng)作(zuò)極其依賴公(gōng)司研發團隊的能(néng)力。因此,有(yǒu)研發不及預期的可(kě)能(néng)性。上市審批速度不及預期:上市及審批受政策和疫情影響。若疫情控制較好,病毒變異并未造成現有(yǒu)疫苗明顯的免疫逃逸,則審批速度有(yǒu)可(kě)能(néng)放緩。銷售不及預期:産(chǎn)品放量依賴市場需求,無論是對于新(xīn)冠疫苗還是公(gōng)司其他(tā)産(chǎn)品,需求的波動都有(yǒu)可(kě)能(néng)造成銷售的起伏。同時,競品或替代品的出現也有(yǒu)可(kě)能(néng)對銷售造成沖擊。
攜手艾博生物(wù)打造第一款國(guó)産(chǎn)mRNA疫苗。5月11日,公(gōng)司公(gōng)告與蘇州艾博生物(wù)簽署合作(zuò)協議,緻力于開展新(xīn)冠mRNA疫苗的臨床前、臨床研究并實施商(shāng)業化生産(chǎn)。蘇州艾博生物(wù)具(jù)有(yǒu)mRNA疫苗設計的核心技(jì )術,其CEO英博先生曾供職于國(guó)際mRNA疫苗巨頭Moderna。沃森生物(wù)則擁有(yǒu)臨床注冊、研究、産(chǎn)業化和營銷方面的豐富經驗。公(gōng)司與艾博生物(wù)、軍事科(kē)學(xué)研究院共同研發的mRNA新(xīn)冠疫苗ARCoV是國(guó)内第一款獲批臨床的mRNA疫苗。目前,此款疫苗在國(guó)内進行臨床II期實驗。6月15日,在由BioBAY主辦(bàn)的核酸藥物(wù)研發論壇上,英博透露ARCoV正在啓動海外多(duō)中(zhōng)心III期臨床試驗,5月11日,墨西哥(gē)外交部長(cháng)埃布拉德(dé)宣布将在墨西哥(gē)開展此疫苗的III期臨床試驗,預計志(zhì)願者6000人,實驗将于5月31日開始。ARCoV新(xīn)冠mRNA疫苗的儲藏條件為(wèi)2-8攝氏度,相較于BNT162b2要求的-70攝氏度和mRNA1273的-20攝氏度更為(wèi)寬松。不過寬松的儲藏條件也相應地提高了對疫苗遞送系統要求,由于脂質(zhì)易在高溫條件下發生變質(zhì)、講解,因此需要密切關注ARCoV的有(yǒu)效期以及疫苗保護率是否會因此受到影響。聚焦前沿技(jì )術,提前布局新(xīn)一代核酸類藥物(wù)4月27日,上市公(gōng)司與聖諾生物(wù)醫(yī)藥技(jì )術(蘇州)有(yǒu)限公(gōng)司(簡稱“聖諾生物(wù)”)、Sirnaomics,Inc.(聖諾制藥有(yǒu)限公(gōng)司,簡稱“美國(guó)聖諾”)簽署了抗病毒核酸幹擾藥物(wù)的合作(zuò)協議。聖諾生物(wù)負責完成藥物(wù)的臨床申報所需的臨床前研究,上市公(gōng)司則獲得該藥物(wù)在中(zhōng)國(guó)大陸及港澳台地區(qū)的獨家權利,包括臨床開發、注冊、生産(chǎn)制造和商(shāng)業化銷售的許可(kě)權。公(gōng)司将根據協議向聖諾生物(wù)支付500萬元預付款,3650萬元臨床前研發費用(yòng),以及藥物(wù)在不同臨床開發階段的裏程碑付款和産(chǎn)品銷售分(fēn)成。核酸幹擾(RNA interference,RNAi)類藥物(wù)是新(xīn)一代核酸藥物(wù),通過“沉默”靶基因或基因中(zhōng)的片段産(chǎn)生臨床效果,在治療腫瘤、免疫疾病、傳染疾病、以及神經退行性疾病中(zhōng)有(yǒu)廣闊的前景。RNAi中(zhōng)最重要的2種物(wù)質(zhì)分(fēn)别為(wèi)miRNA和siRNA。在DNA轉錄産(chǎn)生mRNA後,這兩種物(wù)質(zhì)能(néng)夠快速指引RNA分(fēn)解酶對生成的mRNA進行降解,阻止其進一步轉譯為(wèi)能(néng)夠對生物(wù)活動産(chǎn)生影響的蛋白質(zhì),以此變相沉默特定的基因片段。美國(guó)FDA于2018年和2019年11月相繼批準了Alnylam兩款RNAi藥物(wù)的上市申請,适應症分(fēn)别為(wèi)急性肝卟啉症、遺傳性轉甲狀腺素蛋白澱粉樣變性引起的基因紊亂。聖諾生物(wù)本次與沃森生物(wù)的合作(zuò)項目為(wèi)抗流感病毒的小(xiǎo)幹擾核酸藥物(wù)STP702。STP702預定的給藥途徑為(wèi)霧化吸入,目前該項目在中(zhōng)美均處于IND準備階段。13價肺炎疫苗開始貢獻收入,國(guó)際化銷售錦上添花(huā)。2021年第一季度,控股子公(gōng)司玉溪沃森的13價肺炎疫苗獲批簽發164.3萬瓶,以達到2020年全年批簽發量的36.8%。同時,子公(gōng)司與摩洛哥(gē)MarocVax達成排他(tā)性協議。雙方将先開展成品供應合作(zuò),同時進行部分(fēn)技(jì )術轉移。MarocVax保證在收到完整産(chǎn)品注冊檔案後18個月内獲得上市許可(kě)。2021年,此疫苗于摩洛哥(gē)的銷量約為(wèi)200萬劑。技(jì )術轉移後,MarocVax将繼續采購(gòu)至少等同于200萬劑的疫苗原液。我們預測公(gōng)司的13價肺炎疫苗将在2021年繼續放量,并成為(wèi)公(gōng)司的主要營收來源。風險提示研發不及預期:mRNA疫苗的序列設計和遞送系統為(wèi)前沿技(jì )術,可(kě)供參考的成功範例少,研發工(gōng)作(zuò)極其依賴公(gōng)司研發團隊的能(néng)力。因此,有(yǒu)研發不及預期的可(kě)能(néng)性。上市審批速度不及預期:上市及審批受政策和疫情影響。若疫情控制較好,病毒變異并未造成現有(yǒu)疫苗明顯的免疫逃逸,則審批速度有(yǒu)可(kě)能(néng)放緩。銷售不及預期:産(chǎn)品放量依賴市場需求,無論是對于新(xīn)冠疫苗還是公(gōng)司其他(tā)産(chǎn)品,需求的波動都有(yǒu)可(kě)能(néng)造成銷售的起伏。同時,競品或替代品的出現也有(yǒu)可(kě)能(néng)對銷售造成沖擊。

 公(gōng)司業績簡介複星醫(yī)藥廣泛布局醫(yī)藥健康産(chǎn)業鏈,直接運營業務(wù)闆塊包括制藥、醫(yī)療器械和診斷、醫(yī)療服務(wù),并通過參股國(guó)藥控股介入醫(yī)藥商(shāng)業領域。2020年,複星醫(yī)藥實現營業收入303.07億元,同比增長(cháng)6.02%;歸母淨利潤36.63億元,同比增長(cháng)10.27%。2021年第一季度,公(gōng)司實現營業收入80.56億元,同比增長(cháng)37.00%;歸母淨利潤8.47億元,同比增長(cháng)46.78%。加速推進複必泰mRNA疫苗國(guó)内落地。5月9日,公(gōng)司公(gōng)告子公(gōng)司複星醫(yī)藥産(chǎn)業與BioNTech設立合資公(gōng)司,以實現mRNA新(xīn)冠疫苗産(chǎn)品的本地化生産(chǎn)及商(shāng)業化。雙方分(fēn)别認繳合資公(gōng)司注冊資本的50%,BioNTech以技(jì )術和許可(kě)等無形資産(chǎn)方式出資。複星醫(yī)藥産(chǎn)業應提供産(chǎn)能(néng)可(kě)達10億劑的生産(chǎn)設施。根據《供貨協議》,如以新(xīn)冠疫苗成品供貨,複星醫(yī)藥産(chǎn)業與BioNTech按65%、35%的比例分(fēn)享年度銷售毛利;如以大包裝(zhuāng)制劑供貨,複星醫(yī)藥産(chǎn)業(或其關聯公(gōng)司)、BioNTech按60%、40%的比例分(fēn)享年度銷售毛利。BNT162b2 mRNA新(xīn)冠疫苗在大中(zhōng)華區(qū)的商(shāng)品名(míng)為(wèi)複必泰。2021年1月,疫苗國(guó)内II期臨床試驗已完成所有(yǒu)受試者第二針的接種。在病毒變異以及疫苗有(yǒu)效期的雙重推動下,新(xīn)冠疫苗有(yǒu)望迎來第二輪需求。截至2021年6月30日,香港共已接種2,154,082劑複必泰疫苗。根據2020年12月11日香港政府發布的采購(gòu)公(gōng)告,香港政府計劃采購(gòu)750萬劑複必泰。複星醫(yī)藥2021年第一季度報告顯示公(gōng)司經營活動産(chǎn)生的現金流量淨額達到約7.37億元,同比增加92.62%,主要原因之一為(wèi)收到中(zhōng)國(guó)香港及中(zhōng)國(guó)澳門政府mRNA新(xīn)冠疫苗首付款以及支付相關采購(gòu)支出與研發銷售費用(yòng)後的淨貢獻。國(guó)内首款CAR-T産(chǎn)品上市,為(wèi)淋巴瘤患者帶來新(xīn)曙光。2021年6月23日,複星凱特阿基倫賽注射液(商(shāng)品名(míng):奕凱達)獲NMPA批準上市,成為(wèi)了國(guó)内第一款獲批的CAR-T細胞産(chǎn)品。奕凱達由吉利德(dé)科(kē)學(xué)控股子公(gōng)司Kite Pharma的Yescarta技(jì )術轉移而來,國(guó)内獲批适應症為(wèi)二線(xiàn)及以上治療後複發或難治性大B細胞淋巴瘤。複興凱特在針對中(zhōng)國(guó)患者的難治性侵襲性大B細胞淋巴瘤的實驗中(zhōng)ORR達到79.2%,其中(zhōng)完全緩解率(CR)達到51%,部分(fēn)緩解率(PR)達到21%。與Yescarta的臨床和真實世界數據高度相似。2020年Yescarta全球銷售額約6.07億美元,同比增長(cháng)33%。2021年第一季度,Yescarta銷售額進一步上升至1.6億美元。公(gōng)司前期研發投入進入收獲期,新(xīn)品成為(wèi)營收增量主要動力。阿達木(mù)單抗、曲妥珠單抗、CAR-T細胞治療等多(duō)個産(chǎn)品已獲批上市,成為(wèi)公(gōng)司營收新(xīn)的增長(cháng)點。其中(zhōng)漢利康(利妥昔單抗注射液)于2019年獲批上市,用(yòng)于治療非霍奇金淋巴瘤,并新(xīn)獲批适應症初治濾泡性淋巴瘤以及先前未經治療或複發性/難治性慢性淋巴細胞白血病。2020年全年創造銷售收入7.5億元,已成為(wèi)公(gōng)司銷售額最大的幾個品種之一。漢曲優(注射用(yòng)曲妥珠單抗)于2020年8月在國(guó)内獲批上市,用(yòng)于治療HER2陽性的轉移性乳腺癌、HER2陽性的早期乳腺癌、HER2陽性的轉移性胃腺癌或胃食管交界處腺癌。2020年7月,漢曲優獲歐盟委員會(EC)批準上市。2020年全年貢獻銷售收入1.4億元。蘇可(kě)欣(馬來酸阿伐曲泊帕片)于2020年8月開始上市銷售,用(yòng)于治療慢性肝病相關的血小(xiǎo)闆減少症。2020年實現銷售收入1.4億元,并于年底納入國(guó)家醫(yī)保目錄。公(gōng)司布局多(duō)條創新(xīn)藥研發管線(xiàn),為(wèi)長(cháng)期發展做好戰略儲備。公(gōng)司在創新(xīn)藥方面持續投入,研發費用(yòng)率穩定在10%左右,逐步接近國(guó)際制藥巨頭水平。公(gōng)司2020年研發投入40.03億元,研發費用(yòng)27.95億元。截至2020年末,公(gōng)司在研創新(xīn)藥項目達56項,其中(zhōng)自研小(xiǎo)分(fēn)子創新(xīn)藥18項(臨床階段8項),自研生物(wù)創新(xīn)藥25項(臨床階段15項),許可(kě)引進創新(xīn)藥13項(臨床階段6項)。為(wèi)未來長(cháng)期發展做好戰略儲備。
公(gōng)司業績簡介複星醫(yī)藥廣泛布局醫(yī)藥健康産(chǎn)業鏈,直接運營業務(wù)闆塊包括制藥、醫(yī)療器械和診斷、醫(yī)療服務(wù),并通過參股國(guó)藥控股介入醫(yī)藥商(shāng)業領域。2020年,複星醫(yī)藥實現營業收入303.07億元,同比增長(cháng)6.02%;歸母淨利潤36.63億元,同比增長(cháng)10.27%。2021年第一季度,公(gōng)司實現營業收入80.56億元,同比增長(cháng)37.00%;歸母淨利潤8.47億元,同比增長(cháng)46.78%。加速推進複必泰mRNA疫苗國(guó)内落地。5月9日,公(gōng)司公(gōng)告子公(gōng)司複星醫(yī)藥産(chǎn)業與BioNTech設立合資公(gōng)司,以實現mRNA新(xīn)冠疫苗産(chǎn)品的本地化生産(chǎn)及商(shāng)業化。雙方分(fēn)别認繳合資公(gōng)司注冊資本的50%,BioNTech以技(jì )術和許可(kě)等無形資産(chǎn)方式出資。複星醫(yī)藥産(chǎn)業應提供産(chǎn)能(néng)可(kě)達10億劑的生産(chǎn)設施。根據《供貨協議》,如以新(xīn)冠疫苗成品供貨,複星醫(yī)藥産(chǎn)業與BioNTech按65%、35%的比例分(fēn)享年度銷售毛利;如以大包裝(zhuāng)制劑供貨,複星醫(yī)藥産(chǎn)業(或其關聯公(gōng)司)、BioNTech按60%、40%的比例分(fēn)享年度銷售毛利。BNT162b2 mRNA新(xīn)冠疫苗在大中(zhōng)華區(qū)的商(shāng)品名(míng)為(wèi)複必泰。2021年1月,疫苗國(guó)内II期臨床試驗已完成所有(yǒu)受試者第二針的接種。在病毒變異以及疫苗有(yǒu)效期的雙重推動下,新(xīn)冠疫苗有(yǒu)望迎來第二輪需求。截至2021年6月30日,香港共已接種2,154,082劑複必泰疫苗。根據2020年12月11日香港政府發布的采購(gòu)公(gōng)告,香港政府計劃采購(gòu)750萬劑複必泰。複星醫(yī)藥2021年第一季度報告顯示公(gōng)司經營活動産(chǎn)生的現金流量淨額達到約7.37億元,同比增加92.62%,主要原因之一為(wèi)收到中(zhōng)國(guó)香港及中(zhōng)國(guó)澳門政府mRNA新(xīn)冠疫苗首付款以及支付相關采購(gòu)支出與研發銷售費用(yòng)後的淨貢獻。國(guó)内首款CAR-T産(chǎn)品上市,為(wèi)淋巴瘤患者帶來新(xīn)曙光。2021年6月23日,複星凱特阿基倫賽注射液(商(shāng)品名(míng):奕凱達)獲NMPA批準上市,成為(wèi)了國(guó)内第一款獲批的CAR-T細胞産(chǎn)品。奕凱達由吉利德(dé)科(kē)學(xué)控股子公(gōng)司Kite Pharma的Yescarta技(jì )術轉移而來,國(guó)内獲批适應症為(wèi)二線(xiàn)及以上治療後複發或難治性大B細胞淋巴瘤。複興凱特在針對中(zhōng)國(guó)患者的難治性侵襲性大B細胞淋巴瘤的實驗中(zhōng)ORR達到79.2%,其中(zhōng)完全緩解率(CR)達到51%,部分(fēn)緩解率(PR)達到21%。與Yescarta的臨床和真實世界數據高度相似。2020年Yescarta全球銷售額約6.07億美元,同比增長(cháng)33%。2021年第一季度,Yescarta銷售額進一步上升至1.6億美元。公(gōng)司前期研發投入進入收獲期,新(xīn)品成為(wèi)營收增量主要動力。阿達木(mù)單抗、曲妥珠單抗、CAR-T細胞治療等多(duō)個産(chǎn)品已獲批上市,成為(wèi)公(gōng)司營收新(xīn)的增長(cháng)點。其中(zhōng)漢利康(利妥昔單抗注射液)于2019年獲批上市,用(yòng)于治療非霍奇金淋巴瘤,并新(xīn)獲批适應症初治濾泡性淋巴瘤以及先前未經治療或複發性/難治性慢性淋巴細胞白血病。2020年全年創造銷售收入7.5億元,已成為(wèi)公(gōng)司銷售額最大的幾個品種之一。漢曲優(注射用(yòng)曲妥珠單抗)于2020年8月在國(guó)内獲批上市,用(yòng)于治療HER2陽性的轉移性乳腺癌、HER2陽性的早期乳腺癌、HER2陽性的轉移性胃腺癌或胃食管交界處腺癌。2020年7月,漢曲優獲歐盟委員會(EC)批準上市。2020年全年貢獻銷售收入1.4億元。蘇可(kě)欣(馬來酸阿伐曲泊帕片)于2020年8月開始上市銷售,用(yòng)于治療慢性肝病相關的血小(xiǎo)闆減少症。2020年實現銷售收入1.4億元,并于年底納入國(guó)家醫(yī)保目錄。公(gōng)司布局多(duō)條創新(xīn)藥研發管線(xiàn),為(wèi)長(cháng)期發展做好戰略儲備。公(gōng)司在創新(xīn)藥方面持續投入,研發費用(yòng)率穩定在10%左右,逐步接近國(guó)際制藥巨頭水平。公(gōng)司2020年研發投入40.03億元,研發費用(yòng)27.95億元。截至2020年末,公(gōng)司在研創新(xīn)藥項目達56項,其中(zhōng)自研小(xiǎo)分(fēn)子創新(xīn)藥18項(臨床階段8項),自研生物(wù)創新(xīn)藥25項(臨床階段15項),許可(kě)引進創新(xīn)藥13項(臨床階段6項)。為(wèi)未來長(cháng)期發展做好戰略儲備。 風險提示研發不及預期:公(gōng)司參與大量創新(xīn)藥的研發。因此,有(yǒu)研發不及預期的可(kě)能(néng)性。監管審批速度不及預期:上市及審批受政策和疫情影響。若疫情控制較好,病毒變異并未造成現有(yǒu)疫苗明顯的免疫逃逸,則審批速度有(yǒu)可(kě)能(néng)放緩。疫情惡化風險:若疫情持續惡化,病毒變異速度加快,則有(yǒu)可(kě)能(néng)造成疫苗有(yǒu)效率的下降。同時也對公(gōng)司其他(tā)産(chǎn)品的銷售造成影響。
風險提示研發不及預期:公(gōng)司參與大量創新(xīn)藥的研發。因此,有(yǒu)研發不及預期的可(kě)能(néng)性。監管審批速度不及預期:上市及審批受政策和疫情影響。若疫情控制較好,病毒變異并未造成現有(yǒu)疫苗明顯的免疫逃逸,則審批速度有(yǒu)可(kě)能(néng)放緩。疫情惡化風險:若疫情持續惡化,病毒變異速度加快,則有(yǒu)可(kě)能(néng)造成疫苗有(yǒu)效率的下降。同時也對公(gōng)司其他(tā)産(chǎn)品的銷售造成影響。