
基因治療的概念是在20世紀70年代初提出來的,最初的概念是引入一個正常的基因來取代一個突變基因,雖然現在有(yǒu)更多(duō)的替代方法,如基因編輯和堿基編輯,但它仍然是我們高度依賴的主要策略之一。
2012年歐洲批準Glybera,這是西方國(guó)家首個基因治療産(chǎn)品,也是全球首個針對基因疾病的基因治療。盡管Glylbera在商(shāng)業上并不成功,但它打開了基因治療的大門。在随後的幾年裏,一些基因治療産(chǎn)品陸續湧入市場,Strimvelis于2016年在歐洲獲得批準,CAR-T療法(Kymriah和Yescarta)和Luxturna分(fēn)别于2017年獲得美國(guó)食品和藥物(wù)管理(lǐ)局(FDA)的批準。
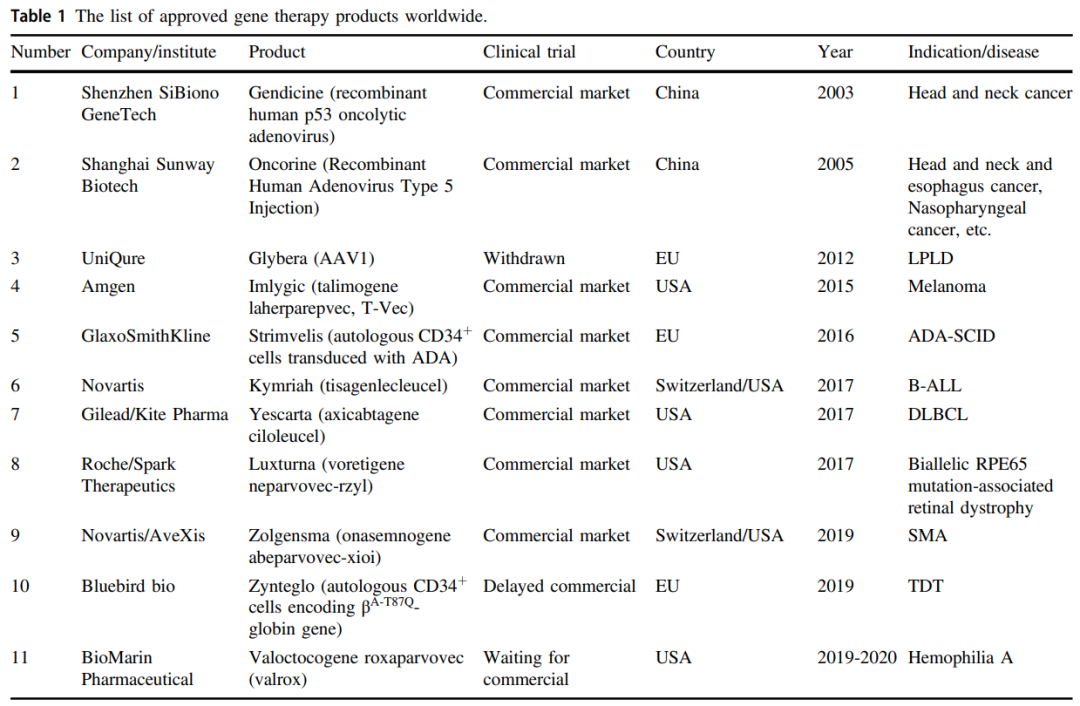
中(zhōng)國(guó)很(hěn)早就接受了基因治療,中(zhōng)國(guó)的第一個基因治療臨床試驗可(kě)以追溯到1991年,距離1990年美國(guó)國(guó)立衛生研究院(NIH)首次進行基因治療僅一年。此外,中(zhōng)國(guó)在2003年批準了世界上第一個基因治療産(chǎn)品Gendicine,Gendicine是一種具(jù)有(yǒu)p53的溶瘤腺病毒,用(yòng)于治療晚期頭頸癌。第一個CRISPR臨床試驗也在中(zhōng)國(guó)進行。中(zhōng)國(guó)的基因治療既有(yǒu)國(guó)際共同點,又(yòu)有(yǒu)自己的特點。
血友病
中(zhōng)國(guó)血友病患病率為(wèi)每10萬人3.6人,男性患病率為(wèi)5.5/10萬,低于普遍報告的全球流行率——每10萬人10人。然而,考慮到我國(guó)人口衆多(duō),這是影響衆多(duō)家庭的最具(jù)影響的遺傳病之一。
1991年,在中(zhōng)國(guó)進行了血友病B(HB)基因治療的臨床試驗,這是繼美國(guó)ADA-SCID試驗後僅一年的世界上第二次人類基因治療試驗,也是第一次人類血友病基因治療試驗。血友病A(HA)和HB是嚴重的X連鎖出血性疾病,主要影響男性。HA和HB分(fēn)别由血液中(zhōng)因子VIII(FVIII)或因子IX(FIX)的缺陷或減少引起。
血友病基因治療在二十一世紀取得了迅速的進展。然而,在我國(guó),從1991年開始,到現在還沒有(yǒu)進一步的血友病臨床試驗。目前,clinialtrials.gov上登記有(yǒu)兩項臨床試驗,一項由天津市血液病醫(yī)院研究所發起,采用(yòng)單劑量靜脈注射BBM-H901的AAV載體(tǐ)進行HB基因治療(NCT04135300),目前正在招募3名(míng)參與者。另一項深圳市遺傳免疫醫(yī)學(xué)院發起,慢病毒FVIII基因修飾HSPC移植HA試驗(NCT03217032),但臨床試驗至今仍處于未招募狀态。目前,重點仍集中(zhōng)在基礎研究工(gōng)作(zuò)。
β地中(zhōng)海貧血
引起血紅蛋白β-珠蛋白鏈表達減少或消除的突變可(kě)導緻β-地中(zhōng)海貧血。目前,已經鑒定出200多(duō)種影響人類β-珠蛋白基因的突變。在中(zhōng)國(guó),由β-珠蛋白基因内含子2的654位核苷酸C到T替換引起的β654地中(zhōng)海貧血是最常見的形式,約占β-地中(zhōng)海貧血病例總數的五分(fēn)之一。β地中(zhōng)海貧血在中(zhōng)國(guó)南部包括廣西、廣東和海南省最為(wèi)流行。特别是在廣西,有(yǒu)20-31.5%的人口是地中(zhōng)海貧血基因攜帶者。
從美國(guó)和歐洲的臨床試驗來看,β-地中(zhōng)海貧血的基因治療在安(ān)全性和有(yǒu)效性方面取得了巨大成功。然而,β地中(zhōng)海貧血基因治療在我國(guó)尚處于起步階段。關于β-地中(zhōng)海貧血基因治療的療效,還沒有(yǒu)公(gōng)開的臨床數據,甚至臨床前研究的數量也非常有(yǒu)限。
體(tǐ)細胞基因編輯的臨床試驗
體(tǐ)細胞基因編輯通過治療遺傳病、傳染病和獲得性疾病,在體(tǐ)内顯示了它的潛力。基因編輯的臨床試驗從ZFN開始,ZFN首次應用(yòng)于“柏林病人”的HIV體(tǐ)外基因治療。ZFN的試驗現已擴展到血友病、法布裏病、MPS II和珠蛋白營養不良。2019年,美國(guó)FDA批準了基因編輯臨床試驗(NCT03872479),使用(yòng)EDIT-101對遺傳性嚴重視網膜營養不良Leber先天性黑矇10型(LCA10)進行體(tǐ)内治療,EDIT-101是第一個體(tǐ)内CRISPR試驗。
在中(zhōng)國(guó),迄今為(wèi)止所有(yǒu)的基因編輯試驗都是基于CRISPR導向的體(tǐ)外策略。來自四川大學(xué)的LU等人首次在臨床試驗中(zhōng)使用(yòng)CRISPR敲除自體(tǐ)T細胞上的PD-1,目的是治愈非小(xiǎo)細胞肺癌(NCT02793856)。根據最近公(gōng)布的數據,12名(míng)患者接受自體(tǐ)PD-1編輯的T細胞輸注,植入PD-1陰性T細胞似乎是安(ān)全的。杭州市腫瘤醫(yī)院開展的另一項試驗采用(yòng)了相同的策略,治療晚期食管癌患者(NCT03081715)。然而,本試驗的臨床結果尚未發表,因此很(hěn)難評價其安(ān)全性和有(yǒu)效性。最近,Xu等人報道使用(yòng)CRISPR敲除HSPC中(zhōng)的CCR5受體(tǐ)基因,并将其移植到同時患有(yǒu)HIV和急性淋巴細胞白血病的患者身上。盡管沒有(yǒu)證據表明對HIV有(yǒu)治療作(zuò)用(yòng),但該研究首次在人類證據中(zhōng)表明CRISPR至少在19個月的随訪期間是安(ān)全的,這可(kě)能(néng)會鼓勵使用(yòng)CRISPR編輯的HSPC進行其他(tā)體(tǐ)外基因治療,如β-地中(zhōng)海貧血和鐮狀細胞疾病。
人類胚胎的基因編輯
2015年,Huang等人報道了人類胚胎中(zhōng)第一個CRISPR基因編輯。為(wèi)了減少倫理(lǐ)壓力,他(tā)們使用(yòng)了三原核(3PN)合子,這種合子有(yǒu)一個卵母細胞核和兩個精(jīng)子核,與植入後的自然流産(chǎn)有(yǒu)關。他(tā)們發現CRISPR能(néng)高效切割人類胚胎中(zhōng)的内源性β-珠蛋白基因(HBB)。重要的是,這項研究還表明,人類胚胎中(zhōng)的基因編輯遠(yuǎn)未成熟,已編輯胚胎的高脫靶率和嵌合體(tǐ)率也很(hěn)高。
然而,2018年,南方科(kē)技(jì )大學(xué)的副教授賀建奎用(yòng)CRISPR對人類胚胎進行基因編輯,目的是制造基因編輯的嬰兒。這是在科(kē)學(xué)和道德(dé)層面上都非常嚴重的不當行為(wèi)。他(tā)的行為(wèi)引起了國(guó)際社會的激烈批評,并受到政府、中(zhōng)國(guó)科(kē)學(xué)界和民(mín)衆的強烈譴責,改變生殖細胞将不可(kě)逆轉地改變人類基因庫,違反了現行國(guó)際規範和中(zhōng)國(guó)現行法規。最後,他(tā)在2019年12月因此被判刑3年。顯然,有(yǒu)必要建立一個更廣泛的國(guó)際框架來管理(lǐ)人類基因組編輯。
溶瘤病毒
2003年,我國(guó)批準了世界上第一個基因治療産(chǎn)品Gendicine。兩年後的2005年,上海三威生物(wù)科(kē)技(jì )公(gōng)司開發的另一種溶瘤病毒Oncorine(rAd5-H101)被中(zhōng)國(guó)食品藥品監督管理(lǐ)局(CFDA)批準用(yòng)于治療晚期鼻咽癌。然而,根據clinicaltrial.org上的公(gōng)開信息,從那時起,溶瘤病毒在中(zhōng)國(guó)的臨床試驗就中(zhōng)斷了。直到2019年,三個臨床試驗才開始積極招募。其中(zhōng),有(yǒu)兩項是I期研究,旨在評估表達GM-CSF的減毒HSV-2作(zuò)為(wèi)單一藥物(wù)或與PD-1抗體(tǐ)聯合使用(yòng)的安(ān)全性和有(yǒu)效性(NCT03866525和NCT04386967)。OV在中(zhōng)國(guó)停止的臨床試驗反映出,自Gendicine以來,OV的療效一直沒有(yǒu)得到根本改善,直到最近。
中(zhōng)國(guó)基因治療企業概況朗信生物(wù)
朗信生物(wù)科(kē)技(jì )有(yǒu)限公(gōng)司(Innostellar Biotherapeutics Co.,Ltd)是一家緻力于基因治療創新(xīn)藥研發制造及商(shāng)業化的全球化企業。公(gōng)司目前關注在遺傳性疾病的基因治療領域(眼科(kē)、罕見病、單基因遺傳疾病),已有(yǒu)多(duō)個管線(xiàn)産(chǎn)品研發及工(gōng)業化技(jì )術開發基礎。
信念醫(yī)藥
信念醫(yī)藥創立于2016年9月,是一家集基因治療藥物(wù)研發、生産(chǎn)和臨床應用(yòng)為(wèi)一體(tǐ)的高科(kē)技(jì )企業。BBM-H901注射液是信念醫(yī)藥開發的一款AAV基因治療藥物(wù),旨在通過靜脈給藥将人凝血因子IX(Factor IX,FIX)基因導入血友病B患者體(tǐ)内,從而提高并長(cháng)期維持患者體(tǐ)内凝血因子水平,以期達到“一次給藥、長(cháng)期有(yǒu)效”的治療及預防出血效果。BBM-H901注射液藥物(wù)的設計采用(yòng)了肝靶向性血清型和高效基因表達盒,目前已進入臨床階段。
中(zhōng)因科(kē)技(jì )
北京中(zhōng)因科(kē)技(jì )是一家專業從事遺傳性眼病臨床基因診斷、生育預防和基因治療藥物(wù)研發的國(guó)家高新(xīn)技(jì )術企業,也是國(guó)内率先進行眼科(kē)基因治療藥物(wù)研發的企業。2021年8月13日,美國(guó)食品和藥品監督管理(lǐ)局(FDA)已授予其在研原創新(xīn)藥“重組人CYP4V2基因腺相關病毒注射液”(ZVS101e注射液)孤兒藥資格認定,用(yòng)于治療結晶樣視網膜色素變性(BCD)。
芳拓生物(wù)
方拓公(gōng)司由泓元資本與奧博資本共同發起設立,公(gōng)司緻力于建立具(jù)有(yǒu)拓展性的、規模化基因治療藥物(wù)研發平台,研發和生産(chǎn)高質(zhì)量的、患者可(kě)負擔的rAAV載體(tǐ)基因治療産(chǎn)品,滿足全球患者一針治愈的臨床治療需求。公(gōng)司産(chǎn)品線(xiàn)覆蓋眼科(kē)、血液、遺傳代謝(xiè)性疾病、神經肌肉等多(duō)個疾病領域。
紐福斯
2021年7月,眼科(kē)疾病的基因治療公(gōng)司紐福斯宣布,中(zhōng)國(guó)首個臨床階段的眼科(kē)體(tǐ)内腺相關病毒(AAV)基因治療藥物(wù)NR082(NFS-01)用(yòng)于ND4線(xiàn)粒體(tǐ)基因突變引起的Leber遺傳性視神經病變(LHON)第一階段臨床試驗在中(zhōng)國(guó)完成首例患者入組及給藥。 NR082是國(guó)内首個獲得臨床試驗許可(kě)的眼科(kē)體(tǐ)内AAV基因治療藥物(wù),并已于2020年9月獲得美國(guó)FDA孤兒藥認定,為(wèi)該産(chǎn)品加速國(guó)際化開發奠定了基礎。
輝大基因
輝大基因成立于在2018年,緻力于通過創新(xīn)的CRISPR基因編輯技(jì )術研發單基因罕見疾病和威脅人類健康的慢性病的基因替代和基因編輯等基因治療藥物(wù)。2021年5月,輝大基因完成4億元B輪融資。目前輝大基因擁有(yǒu)三大研發平台:基因編輯平台、遞送載體(tǐ)平台、動物(wù)模型平台。
博雅輯因
博雅輯因是一家以基因組編輯技(jì )術為(wèi)基礎,針對多(duō)種疾病加速藥物(wù)研究并開發創新(xīn)療法的生物(wù)醫(yī)藥企業,在2020年10月順利完成4.5億元人民(mín)币的B輪融資。2021年4月21日,博雅輯因宣布順利完成4億元人民(mín)币的B+輪融資。本輪融資資金将被用(yòng)于繼續推進公(gōng)司以基因編輯技(jì )術為(wèi)基礎的産(chǎn)品管線(xiàn)的臨床轉化,并推動公(gōng)司的産(chǎn)業化發展。
中(zhōng)吉智藥
中(zhōng)吉智藥是一家集基因治療創新(xīn)藥物(wù)的研發、生産(chǎn)、銷售為(wèi)一體(tǐ)的生物(wù)制藥企業,在基因表達調控和基因治療領域擁有(yǒu)超過20年的深厚底蘊,已布局多(duō)個罕見遺傳病基因治療項目。2021年10月,公(gōng)司已經完成Pre-A輪數千萬元人民(mín)币融資,投資方為(wèi)其瑞佑康。融資款項用(yòng)于推動并完成RDEB基因治療IIT研究,以及β-地中(zhōng)海貧血基因治療的IIT研究。
鼎新(xīn)基因
上海鼎新(xīn)基因科(kē)技(jì )有(yǒu)限公(gōng)司由生物(wù)制藥領域資深管理(lǐ)團隊和科(kē)學(xué)家團隊聯合創立,創始團隊均有(yǒu)15+年生物(wù)醫(yī)藥及基因治療相關研究經驗。作(zuò)為(wèi)一家以基因治療藥物(wù)研發為(wèi)核心的生物(wù)醫(yī)藥創新(xīn)研發企業,緻力于打造國(guó)際一流的基因治療研發平台,并不斷開發First-in-class及Best-in-class基因治療藥物(wù)。
嘉因生物(wù)
杭州嘉因生物(wù)科(kē)技(jì )有(yǒu)限公(gōng)司(簡稱“嘉因生物(wù)”)成立于2019年7月,位于杭州省級醫(yī)藥港小(xiǎo)鎮,是一家緻力于面向全球市場提供安(ān)全有(yǒu)效基因療法的創新(xīn)藥企。其不僅在研發管線(xiàn)、技(jì )術平台等方面具(jù)有(yǒu)差異化的競争優勢,在病毒生産(chǎn)工(gōng)藝及大規模量産(chǎn)方面更是具(jù)備國(guó)際領先的水平。
九天生物(wù)
九天生物(wù)醫(yī)藥(上海)有(yǒu)限公(gōng)司(Geneception)成立于2019年,聚焦世界前沿的基因和細胞治療領域,立足中(zhōng)國(guó),放眼全球。針對罕見病及癌症治療領域,推動新(xīn)藥研發與上市,滿足病患需求。據悉,九天生物(wù)A輪總融資金額1.5億美元。
諾潔貝生物(wù)
諾潔貝生物(wù)成立于2020年3月,由基因治療領域資深的科(kē)學(xué)家、企業家聯合創立,緻力成為(wèi)具(jù)有(yǒu)國(guó)際影響力的全球領先的基因治療公(gōng)司。2021年4月,蘇州諾潔貝生物(wù)技(jì )術有(yǒu)限公(gōng)司已完成3000萬美元A輪融資,此輪融資主要用(yòng)于諾潔貝生物(wù)多(duō)款基因治療管線(xiàn)的臨床産(chǎn)品的準備和cGMP生産(chǎn)車(chē)間的建設。
鼐濟醫(yī)藥
鼐濟醫(yī)藥是一家集基因治療藥物(wù)研發、生産(chǎn)和臨床應用(yòng)為(wèi)一體(tǐ)的高新(xīn)技(jì )術企業,成立之初已完成近億元融資,緻力于通過國(guó)際前沿的基因治療技(jì )術,為(wèi)多(duō)種遺傳疾病和癌症加速藥物(wù)研究以及開發創新(xīn)療法。擁有(yǒu)一支具(jù)備豐富的基因治療和細胞治療研發經驗的專業管理(lǐ)團隊,團隊在基因治療技(jì )術、藥物(wù)開發與生産(chǎn)、臨床研究以及注冊申報等各個重要環節均擁有(yǒu)豐富經驗。
珠海貝斯昂科(kē)
貝斯生物(wù)于2021年4月正式成立。該公(gōng)司由在生物(wù)醫(yī)學(xué)領域具(jù)有(yǒu)20年臨床醫(yī)生、科(kē)研、創業、和風險投資經驗的徐天宏博士發起創立,專注于研發新(xīn)型基因編輯NK細胞治療産(chǎn)品及基因治療産(chǎn)品。貝斯生物(wù)近日完成近億元天使輪融資,該輪融資資金将主要用(yòng)于貝斯生物(wù)獨特的基因編輯NK平台及基因治療平台的升級、産(chǎn)品研發、專利池的構建以及相關團隊建設。
吉凱基因
吉凱基因設立至今,一直利用(yòng)RNAi等技(jì )術,開展藥物(wù)靶标發現及其衍生業務(wù)。公(gōng)司業務(wù)覆蓋靶标篩選及驗證、抗體(tǐ)藥物(wù)及基因治療/細胞治療藥物(wù)的臨床前研究以及I期臨床研究等藥物(wù)開發流程中(zhōng)的源頭創新(xīn)階段。目前公(gōng)司通過自主創新(xīn)研究已主要開發了15個進入IND研究階段的新(xīn)藥研發項目,其中(zhōng)7個已許可(kě)或轉讓,公(gōng)司仍在繼續開發的項目中(zhōng)有(yǒu)1個進入IND申請階段。
至善唯新(xīn)
至善唯新(xīn)成立于2018年,是一家專注rAAV基因藥物(wù)研發與生産(chǎn)的基因治療企業,治療領域涵蓋血液疾病、罕見病等。2021年2月,至善唯新(xīn)宣布完成數億元人民(mín)币A輪融資。
北京合生基因
2020 年 11 月 27 日,合生基因宣布其基于國(guó)内原創的合成生物(wù)技(jì )術開發的首款基因治療産(chǎn)品 SynOV1.1 獲得美國(guó) FDA 臨床試驗許可(kě),用(yòng)于治療包括中(zhōng)晚期肝癌在内的甲胎蛋白(AFP)陽性實體(tǐ)瘤。
原基華毅原基華毅目前已開發多(duō)條基因治療研發管線(xiàn)。該公(gōng)司由首都醫(yī)科(kē)大學(xué)校長(cháng),著名(míng)學(xué)者饒毅教授創立。旗下公(gōng)司有(yǒu)華毅亮健等。邦耀生物(wù)
公(gōng)司科(kē)學(xué)家團隊在基因編輯工(gōng)具(jù)開發和基因治療地中(zhōng)海貧血領域,已經持續取得一系列突破性進展,利用(yòng)基因編輯技(jì )術重新(xīn)開啓胎兒期的γ珠蛋白的表達,代替有(yǒu)缺陷的β珠蛋白,期待成為(wèi)治愈地貧患者的治療方案之一。
新(xīn)芽基因
新(xīn)芽基因成立于2020年7月,由何春豔博士和常興博士聯合創立。2021年7月,蘇州新(xīn)芽基因生物(wù)技(jì )術有(yǒu)限公(gōng)司宣布已完成數千萬人民(mín)币Pre-A輪融資。
目鏡生物(wù)
上海目鏡生物(wù)醫(yī)藥科(kē)技(jì )有(yǒu)限公(gōng)司是一家專注于基因工(gōng)程化定向進化技(jì )術開發新(xīn)型AAV外殼用(yòng)于眼科(kē)疾病基因治療技(jì )術和産(chǎn)品研發的創新(xīn)公(gōng)司。作(zuò)為(wèi)一家創新(xīn)型生物(wù)醫(yī)藥企業,公(gōng)司緻力于為(wèi)全球眼科(kē)疾病患者帶來光明。目鏡生物(wù)具(jù)有(yǒu)豐富的AMD及其他(tā)眼科(kē)疾病基因治療産(chǎn)品臨床前研發經驗,目前已有(yǒu)一款AMD基因治療的候選藥物(wù)。
丹瑞生物(wù)
上海丹瑞生物(wù)醫(yī)藥科(kē)技(jì )有(yǒu)限公(gōng)司是一家臨床階段的創新(xīn)型生物(wù)醫(yī)藥公(gōng)司,成立于2018年4月。丹瑞中(zhōng)國(guó)自成立之初便一直推動普列威(Provenge)在中(zhōng)國(guó)的上市,并緻力于将丹瑞美國(guó)前沿的免疫細胞治療技(jì )術轉移到中(zhōng)國(guó)。丹瑞中(zhōng)國(guó)希望将自身經驗服務(wù)于行業,打造中(zhōng)國(guó)細胞和基因治療的産(chǎn)業化加速器。
此外,藥融雲數據(www.pharnex cloud.com)顯示,目前還有(yǒu)領諾醫(yī)藥、神拓生物(wù)、上海渤因生物(wù)、克睿基因、恒瑞醫(yī)藥、安(ān)龍生物(wù)、天澤雲泰、和度生物(wù)、星明優健(UgeneX Therapeutics)、本導基因、錦籃基因、正序生物(wù)、康璟生物(wù)(AccuGen)、ASCTx、人福醫(yī)藥、北海康成、北京諾思蘭德(dé)生物(wù)、瑞風生物(wù)、NeuExcell Therapeutics、勁威生物(wù)、華大吉諾因、信立泰、康霖生物(wù)、華藥康明、荷塘生華、繼景生物(wù)、吉脈基因等企業緻力于基因治療相關新(xīn)藥開發。
中(zhōng)國(guó)基因治療的監管中(zhōng)國(guó)科(kē)學(xué)家早在上世紀80年代末90年代初就開展了基因治療的基礎研究和臨床試驗。基因治療監管政策最早于1993年出台,到目前為(wèi)止,監管政策的演變大緻可(kě)以分(fēn)為(wèi)三個階段。
第一階段(二十世紀末)
1993年,國(guó)家科(kē)委頒布了《基因工(gōng)程安(ān)全管理(lǐ)辦(bàn)法》,但這一規定并未對基因治療做出具(jù)體(tǐ)規定。同年,衛生部藥監局發布了《人體(tǐ)體(tǐ)細胞治療與基因治療臨床研究質(zhì)量控制要點》,為(wèi)基因治療提供了具(jù)體(tǐ)的質(zhì)量控制指南,對促進基因治療的快速發展發揮了重要作(zuò)用(yòng)。1999年,國(guó)家藥監局頒布了《新(xīn)生物(wù)制品批準辦(bàn)法》和《藥物(wù)臨床試驗管理(lǐ)規範》,将基因治療納入生物(wù)新(xīn)産(chǎn)品和藥物(wù)臨床試驗的監管範圍。因此,在基因治療領域,中(zhōng)國(guó)至今形成了技(jì )術和藥物(wù)兩條監管路徑,以及科(kē)技(jì )、衛生、藥品等主管部門實施的多(duō)元監管模式。總體(tǐ)來看,這個階段的監管政策相對寬松,調控措施相對粗糙。
第二階段(二十一世紀前15年)
21世紀初,我國(guó)已形成了較為(wèi)全面但仍寬松的基因治療監管政策。2003年,國(guó)家食品藥品監督管理(lǐ)局頒布了三項有(yǒu)關人類基因治療的規定。科(kē)技(jì )部、衛生部聯合發布了《人類胚胎幹細胞研究倫理(lǐ)指導原則》。衛生部根據《人類輔助生殖技(jì )術管理(lǐ)辦(bàn)法(2001)》,制定了《人類輔助生殖技(jì )術技(jì )術規範》和《人類輔助生殖技(jì )術和人類精(jīng)子庫倫理(lǐ)原則》,制定了禁止以生殖為(wèi)目的的基因治療臨床試驗的政策。
2007年,衛生部發布了《涉及人體(tǐ)的生物(wù)醫(yī)學(xué)研究倫理(lǐ)審查辦(bàn)法(試行)》,初步規定了基因治療的倫理(lǐ)審查程序。2009年,衛生部發布了《醫(yī)療技(jì )術臨床應用(yòng)管理(lǐ)辦(bàn)法》,将基因治療列為(wèi)第三類應當審批的醫(yī)療技(jì )術。
2009年,衛生部還發布了《臍血幹細胞治療技(jì )術管理(lǐ)規範(試行)》和《基因芯片診斷技(jì )術管理(lǐ)規範》。2010年,國(guó)家食品藥品監督管理(lǐ)局發布了《藥品臨床試驗倫理(lǐ)審查指導原則》。2015年,國(guó)家衛生計生委、國(guó)家食品藥品監督管理(lǐ)局聯合發布了《幹細胞臨床研究管理(lǐ)辦(bàn)法(試行)》、《幹細胞制劑質(zhì)量控制和臨床前研究指導原則(試行)》等監管措施和倫理(lǐ)準則。同年,國(guó)家衛生計生委取消了第三類醫(yī)療技(jì )術臨床應用(yòng)的行政審批,細胞治療和基因治療可(kě)由醫(yī)療機構自行審批。
第三階段(2016年至今)
這一時期的特點是技(jì )術和産(chǎn)業促進、權利保護和風險控制相協調的綜合監管政策。2016年“生物(wù)免疫療法”魏則西事件發生後,國(guó)家衛生計生委立即暫停所有(yǒu)未經批準的第三類醫(yī)療技(jì )術臨床應用(yòng),基因治療監管政策趨于嚴格,但生物(wù)技(jì )術仍然屬于國(guó)家重點推進發展的領域。
在技(jì )術和産(chǎn)業推廣方面,基因治療無論是作(zuò)為(wèi)一種新(xīn)的醫(yī)療技(jì )術,還是作(zuò)為(wèi)一種生物(wù)醫(yī)藥産(chǎn)業,都具(jù)有(yǒu)廣闊的前景。在國(guó)務(wù)院“十三五”國(guó)家戰略性新(xīn)興産(chǎn)業發展規劃(國(guó)發[2016]67号)、“十三五”國(guó)家科(kē)技(jì )創新(xīn)規劃(國(guó)發[2016]43号)中(zhōng),《新(xīn)建六個自由貿易試驗區(qū)方案》(國(guó)發〔2019〕16号)等與經濟社會發展有(yǒu)關的綱領性文(wén)件都對基因治療領域的産(chǎn)業發展給予了鼓勵政策。
而針對人類基因技(jì )術尚未形成系統的法律規定體(tǐ)系(包括基因治療),在法律(狹義)層面上對基因治療沒有(yǒu)直接的規定。現行的監管規範主要是技(jì )術管理(lǐ)方法或倫理(lǐ)準則。我國(guó)基因治療的法律(廣義)框架主要包括國(guó)務(wù)院發布的行政法規、部門規章和國(guó)務(wù)院各部委發布的規範性文(wén)件。
受CRISPR嬰兒事件影響,中(zhōng)國(guó)正在生物(wù)安(ān)全、基因技(jì )術和生物(wù)醫(yī)學(xué)等領域加緊立法。2019年,《生物(wù)安(ān)全法》通過全國(guó)人大常委會第一次審議。中(zhōng)央全面深化改革委員會第九次會議審議通過了“國(guó)家科(kē)技(jì )倫理(lǐ)委員會架構”,緻力于推動建立覆蓋面廣、導向明确的科(kē)技(jì )倫理(lǐ)綜合治理(lǐ)體(tǐ)系。中(zhōng)國(guó)國(guó)家衛生和科(kē)技(jì )部門正在采取相應的立法行動,起草(cǎo)了《生物(wù)醫(yī)藥新(xīn)技(jì )術臨床應用(yòng)管理(lǐ)規定(征求意見稿)》和《生物(wù)技(jì )術研究開發安(ān)全管理(lǐ)規定(征求意見稿)》,目标是形成更加合理(lǐ)的監督機制,加強監督,增加法律責任,促進生物(wù)技(jì )術研發、應用(yòng)及相關産(chǎn)業的健康發展。
小(xiǎo)結雖然近年來基因治療在我國(guó)方興未艾,但要縮小(xiǎo)與西方國(guó)家的差距,仍有(yǒu)許多(duō)工(gōng)作(zuò)要做。首先,我們認為(wèi)公(gōng)衆教育對基因治療的成功至關重要。基因治療作(zuò)為(wèi)一門新(xīn)興的醫(yī)學(xué)門類,正在深刻地改變着醫(yī)藥行業的格局,然而,它還遠(yuǎn)未成熟,也就是說,還有(yǒu)許多(duō)未知數有(yǒu)待探索。當發生嚴重不良事件時,公(gōng)衆的态度可(kě)能(néng)直接決定基因治療的命運。
第二,穩定的資金至關重要。從基因治療的曆史來看,我國(guó)起步較早,但與同期的美國(guó)和歐洲相比,進展緩慢且十分(fēn)有(yǒu)限。
第三,中(zhōng)國(guó)目前對基因治療的監管複雜繁瑣。如何協調不同的規範,簡化規定,有(yǒu)利于我國(guó)基因治療的研究和發展。基因治療的對象通常是那些身體(tǐ)狀況不好的人,他(tā)們迫切需要新(xīn)的治療方法來改善他(tā)們的健康狀況和獲得生命的機會。更好的法規應該有(yǒu)助于縮短從研究到臨床應用(yòng)的時間。
----------THE END----------
免責聲明:本文(wén)系轉載分(fēn)享,文(wén)章觀點、内容、圖片及版權歸原作(zuò)者所有(yǒu),如涉及侵權請聯系删除!